
 将Fe2O3、Al2O3 两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
将Fe2O3、Al2O3 两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:| 0.2mol |
| 0.04L |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.65mol |
| 0.1L |


科目:高中化学 来源: 题型:
 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )| A、HA溶液的物质的量浓度为0 0l mol.L-1 |
| B、b→c的过程中,温度降低的原因是溶液中发生了吸热反应 |
| C、a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) |
| D、25℃时,HA的电离平衡常数K约为1.43×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 穿心莲为爵床科植物,它的提取物为广谱抗菌药,具有清热解毒、消炎止痛的功效,适用于外科常见急性炎症等.其中的活性成分结构简式如图,下列说法正确的是( )
穿心莲为爵床科植物,它的提取物为广谱抗菌药,具有清热解毒、消炎止痛的功效,适用于外科常见急性炎症等.其中的活性成分结构简式如图,下列说法正确的是( )| A、穿心莲分子中有19个碳原子 |
| B、一定条件下能使溴水和高锰酸钾酸性溶液褪色 |
| C、分子内消去一个水分子,产物只有一种 |
| D、分子中含有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 | ||
| A | ①向溶液中通入CO2②继续通入CO2浑浊至过量 | ①溶液变浑浊②浑浊不消失 | 原溶液一定是NaAlO2溶液 | ||
| B | ①想溶液中加入KSCN溶液②滴入一定量盐酸 | ①溶液无明显现象②溶液变为血红色 | 原溶液中可能含有Fe2+NO
| ||
| C | 用洁净帕丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 原溶液一定是钠盐溶液 | ||
| D | 溶液中加入盐酸 | 产生的气体使澄清石灰水变浑浊 | 原溶液中一定含有CO
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用装置制取氯气 用装置制取氯气 |
B、 用装置分离二氧化锰和氯化锰溶液 用装置分离二氧化锰和氯化锰溶液 |
C、 用装置分离萃取后碘水中碘 用装置分离萃取后碘水中碘 |
D、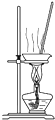 用装置蒸干氯化锰溶液制 MnCl2?4H2O 用装置蒸干氯化锰溶液制 MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 |
| B、将pH=11的氨水稀释1000倍,测得pH>8,说明NH3?H2O为弱碱 |
| C、加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 |
| D、将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
| C、a=0.3 |
| D、ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片与过量浓硝酸(常温) |
| B、铜粉与过量浓硝酸(常温) |
| C、浓盐酸与过量MnO2(共热) |
| D、浓硫酸与过量铜片(共热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com