
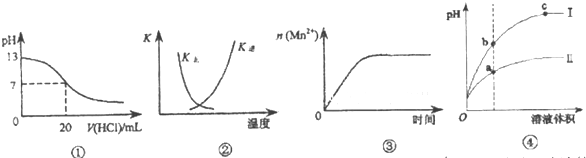
| A、图①表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B、图②中曲线表示反应:2SO2(g)+O2(g)?2SO3(g);△H<0正、逆反应的平衡常数K随温度的变化 |
| C、图③表示10 mL 0.0l mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 |
| D、I为较强酸稀释时pH变化的曲线,且b点溶液的导电性比c点溶液的导电性弱 |


科目:高中化学 来源: 题型:

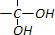
| H2O |
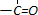
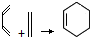
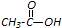
| P2O5 |
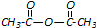
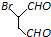 和
和 为原料合成
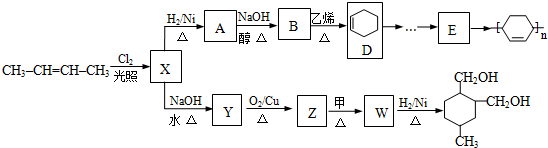
为原料合成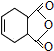 ,请设计合成路线(注明反应条件).
,请设计合成路线(注明反应条件).| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
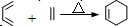
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |
| [o] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白精的有效成分是Ca(ClO)2 |
| B、利用高纯硅的半导体性能,可以制成光电池 |
| C、NO、NO2是大气污染物,能在空气中稳定存在 |
| D、HCl、NH3、BaSO4都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
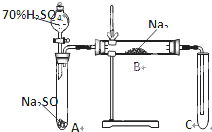 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使反应体系的活化能降低 |
| B、使反应体系的活化分子总数增多 |
| C、使反应体系的活化分子百分数降低 |
| D、使反应体系的活化分子百分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )
向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )| A | B | C | D | |
| 溶液A | 澄清石灰水 | AlCl3溶液 | H2S | Na2SiO3 |
| 过量B | CO2 | KOH | SO2 | H2SO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com