


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
查看答案和解析>>
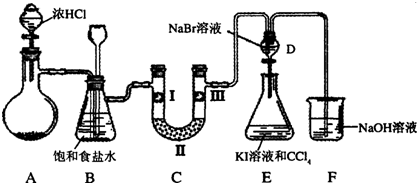
科目:高中化学 来源:不详 题型:填空题
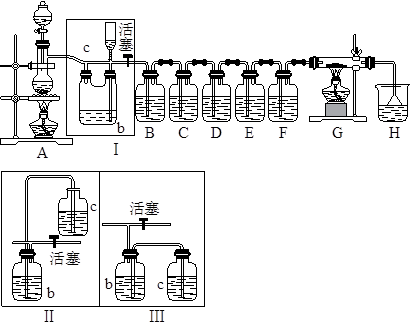
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。

查看答案和解析>>
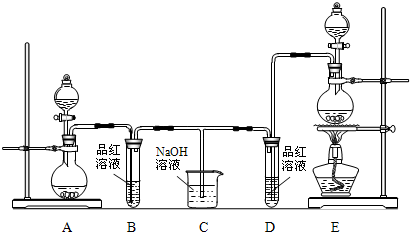
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④⑥ | B.②③⑤ |
| C.①④⑤ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
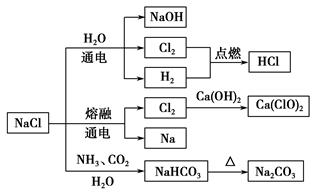
| A.25 ℃时,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
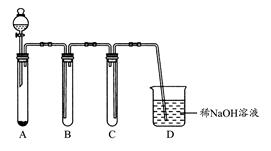
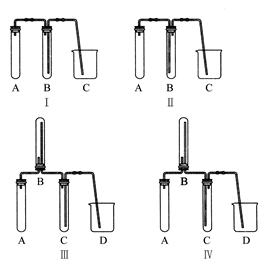
| | 应加入的物质 | 所起的作用 |
| A | | |
| B | | |
| C | | |
| D | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com