
| 容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
| CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
| 甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
| 乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
| 丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
| A. | 该反应正反应为吸热反应 | |
| B. | 达平衡时,容器甲中的逆反应速率比容器乙中的小 | |
| C. | 达平衡时,转化率:α(CO2,甲)+α(C2H5OH,丙)>1 | |
| D. | 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙) |
分析 对比甲、乙容器,起始浓度乙为甲的2倍,相当于在甲的基础上压缩体积,增大压强,平衡正向移动,甲、丙两组数据在数值上相当,如温度相同,则为等效平衡,但丙温度较高,平衡时乙醇的浓度较小,相当于在甲的基础上升高温度,平衡逆向移动,则正反应为放热反应,以此解答该题.
解答 解:A.由以上分析可知该反应的正反应为放热反应,故A错误;
B.乙的浓度比甲大,且温度相同,则乙的反应速率比甲大,故B正确;
C.如甲、丙温度相同,α(CO2,甲)+α(C2H5OH,丙)=1,但丙温度较高,则升高温度平衡逆向移动,α(C2H5OH,丙)较大,则转化率:α(CO2,甲)+α(C2H5OH,丙)>1,故C正确;
D.起始浓度乙为甲的2倍,如平衡状态相同,则2c(CO2,甲)=c(CO2,乙),但增大压强平衡正向移动,则2c(CO2,甲)>c(CO2,乙),故D错误.
故选BC.
点评 本题考查化学平衡的影响,为高频考点,侧重考查学生的分析能力,本题注意把握表中数据的分析和比较,掌握外界条件下对平衡移动的影响,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
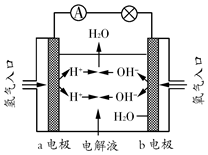 化学电池在通讯、交通及日常生活中有着广泛的应用.
化学电池在通讯、交通及日常生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
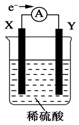 在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++e-═H2↑ | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gCH2═CHCHO中含有双键的数目为0.1NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 粗铜的电解精炼中,阳极质量减轻64g时,转移的电子数为2NA | |
| D. | 15g甲基正离子(+CH3)所含有的电子数是8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
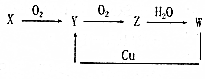 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )| A. | X、Y、Z、W均为含有同种元素的化合物 | |
| B. | 若X能与Y反应,则X、Y-定是H2S和SO2 | |
| C. | Z→W的反应一定是氧化还原反应 | |
| D. | 在W的稀溶液滴入石蕊试剂都显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应可以快速制取单质铁,工业上常用此法冶炼铁 | |
| B. | NaHCO3能与碱反应,食品工业中用做焙制糕点的膨松剂 | |
| C. | K2FeO4具有强氧化性,其产物水解生成Fe(OH)3胶体,故可用于自来水消毒和净化 | |
| D. | SO2具有漂白性,可用于食品的消毒和漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | HC1O具有漂白性 | 湿润的Cl2能使有色布条褪色 |
| B | SiO2具有导电性 | SiO2可用于制光导纤维 |
| C | 铝的金属性比铁强 | 铝制品在空气中比铁制品更容易腐蚀 |
| D | 碳酸钠属于碱类 | 工业上的“三酸二碱”,把碳酸钠归纳为“碱” |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 该反应属于离子反应 | |
| C. | 若有0.1mol氯气参与反应,则转移电子0.1mol | |
| D. | 该反应中Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖能用于补钙药物的合成 | |
| B. | 燃料不完全燃烧排放的CO是大气污染物之一 | |
| C. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| D. | 自来水厂可使用Cl2和FeSO4•7H2O进行消毒、净化、以改善水质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com