
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液呈紫色 | Ⅰ或者Ⅲ |
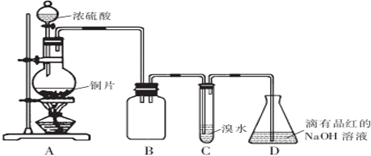
分析 (1)A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸;
(2)C中二氧化硫与溴水反应生成硫酸和溴化氢,依据硫元素化合价变化判断二氧化硫性质;装置D中NaOH全部转化为NaHSO3时碱性降低;
(3)②NaClO可氧化KI;
③溴水可氧化HSO3-;
④HSO3-与高锰酸钾可发生氧化还原反应.
解答 解:(1)A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸;
故答案为:防倒吸;
(2)C中二氧化硫与溴水反应生成硫酸和溴化氢,离子方程式:SO2+Br2+2H2O=4H++SO42-+2Br-,二氧化硫中硫元素化合价升高,体现二氧化硫还原性;装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,
故答案为:还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)②NaClO可氧化KI,则观察到溶液变为蓝色;
③溴水可氧化HSO3-,则观察到溴水褪色,
④HSO3-与高锰酸钾可发生氧化还原反应,由溶液为紫色可知,不存在HSO3-,则I或Ⅲ成立,
故答案为:
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 | I或Ⅲ |
点评 本题考查了物质的制备和性质检验,明确 二氧化硫实验室制备原理及性质是解题关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 传统的无机混凝剂按金属盐可分为铝盐系和铁盐系两大类 | |
| B. | NCl3可用于水消毒的原因是NCl3跟水反应生成了NH3 | |
| C. | 用ClO2代替Cl2作消毒剂可减小水中有害氯代有机物的浓度 | |
| D. | 新型水处理剂高铁酸钠(Na2FeO4)既是消毒剂又是混凝剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在紫外线的照射下会失去生理活性 | |
| B. | 蛋白质溶液不能产生丁达尔效应 | |
| C. | 蛋白质溶液中加入CuSO4可产生盐析现象 | |
| D. | 蚕丝、羊毛、棉花的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 16 g O2和O3的混合气体中,所含氧原子数为0.5NA | |
| C. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| D. | 9g D2O所含的中子数为4.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com