
| ⅠA | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ,故答案为:
,故答案为: ;
;
| ||
| ||
 ,故答案为:
,故答案为: .
.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
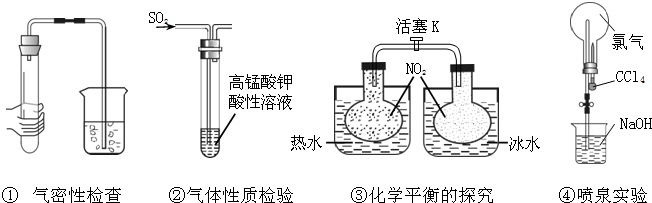
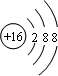
| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良好 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
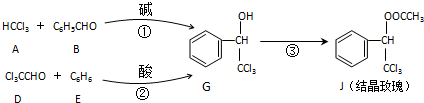
| KOH |
 +
+
| 酸 |
 +H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为
+H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为查看答案和解析>>
科目:高中化学 来源: 题型:
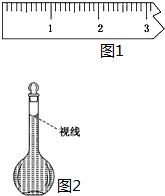 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
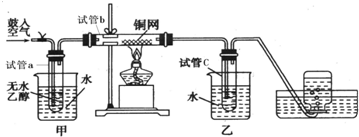
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
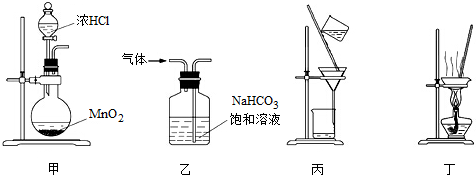
| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中混有的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com