
 盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:
盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:分析 (1)①盐酸和铁锈中的氧化铁反应生成氯化铁和水;
②反应中元素化合价升高的失电子做还原剂被氧化发生氧化反应得到氧化产物,元素化合价降低的做氧化剂被还原反应还原反应;
(2)①依据溶液中溶质相同列式计算需要的溶液体积,配制溶液的步骤为:计算、量取、稀释、转移、洗涤、定容、摇匀等,需要使用的仪器有:量筒、烧杯、100mL容量瓶、胶头滴管、玻璃棒等;
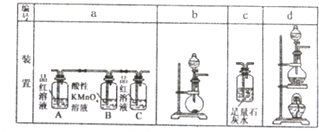
②制备反应在装置d中,检验二氧化碳和二氧化硫时,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,选择装置a,最后通过装置c中石灰水检验二氧化碳的存在;
(3)①在浓硝酸中加入铜片反应生成二氧化氮、硝酸铜和水;
②待反应停止后,若仍有铜剩余,再加入少量稀硫酸,迅速稀硝酸和铜反应,铜片上又有气泡产生是一氧化氮;
③计算物质的物质的量,结合氮元素守恒的定量关系计算.
解答 解:(1)①盐酸和铁锈中的氧化铁反应生成氯化铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
②2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O 的反应,反应中氯酸钾中氯元素化合价+5价降低为+4价,做氧化剂,HCl中氯元素化合价-1价升高为0价,HCl失电子做还原剂被氧化发生氧化反应得到氧化产物Cl2,
故答案为:KClO3;Cl2;
(2)①依据溶液中溶质相同列式计算需要的溶液体积,用质量分数为98%(ρ=1.84g/cm3)浓硫酸配制4.6mol•L-1的稀硫酸100mL,所需浓硫酸的体积为Vml,
Vml×1.84g/cm3×98%=4.6mol•L-1 ×0.100L×98g/molV=25.0ml,配制溶液的步骤为:计算、量取、稀释、转移、洗涤、定容、摇匀等,需要使用的仪器有:量筒、烧杯、100mL容量瓶、胶头滴管、玻璃棒等,
故答案为:25.0ml,100mL容量瓶、胶头滴管;
②制备反应在装置d中,检验二氧化碳和二氧化硫时,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,选择装置a,出现现象A中品红褪色,C中 品红不褪色,说明二氧化硫的存在和除净,最后通过装置c中石灰水变浑浊检验二氧化碳的存在,所以选择装置连接顺序是:dac,
故答案为:dac;
(3)①在浓硝酸中加入铜片反应生成二氧化氮、硝酸铜和水,反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②待反应停止后,若仍有铜剩余,再加入少量稀硫酸,迅速稀硝酸和铜反应,铜片上又有气泡产生是一氧化氮,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
③若将12.8g铜物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,与一定量的硝酸反应,铜完全反应后,共产生标况下气体5.60L,物质的量=$\frac{5.60L}{22.4L/mol}$=0.25mol,结合离子方程式中定量关系计算,Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,铜全部反应生成Cu(NO3)2,硝酸HNO3部分做酸,部分做氧化剂,依据氮元素守恒可知做氧化剂的硝酸物质的量为0.25mol,做酸的物质的量=0.2mol×2=0.4mol,消耗硝酸汞0.4mol+0.25mol=0.65mol,
故答案为:0.65mol.
点评 本题考查了物质性质的分析、溶液配制过程的理解应用、气体检验试验方法的设计、氧化还原反应电子守恒的计算等知识点,主要是铜和不同浓度酸发生反应的定量关系的分析判断,题目难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
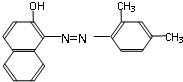 苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法错误的是( )
苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示.下列关于“苏丹红Ⅱ号”说法错误的是( )| A. | 分子中含有一个苯环和一个萘环 | |
| B. | 化学式为C18H16N2O,属于芳香烃 | |
| C. | 能使酸性高锰酸钾溶液褪色 | |
| D. | 一定条件下可以和氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:5 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢不稳定 | |
| B. | 酸性强弱顺序:HClO4>H3AsO4>H2SeO4 | |
| C. | 硒与铁反应可生成FeSe | |
| D. | 最高氧化物的化学式是SeO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com