
 y C��g��; ��H <0��һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺
y C��g��; ��H <0��һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺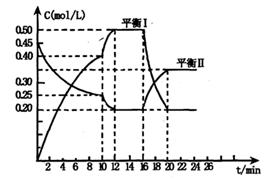


 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A����Ӧ�Ļ�ѧ����ʽΪ��2M N N |
| B��t2ʱ�����淴Ӧ������ȣ��ﵽƽ�� |
| C��t3ʱ������Ӧ���ʴ����淴Ӧ���� |
| D��t1ʱ��N��Ũ����MŨ�ȵ�2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CO(g)+3H2(g) ��H=+206.0kJ?mol��1
CO(g)+3H2(g) ��H=+206.0kJ?mol��1 CH3OH(g) ��H=��129.0kJ?mol��1
CH3OH(g) ��H=��129.0kJ?mol��1
| A��ƽ�ⳣ��K���� | B������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� |
| C��CH3OH�����ʵ������� | D������ƽ��c(H2)/c(CH3OH)��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)������2s����C��Ũ��Ϊ0.6mol��L-1���������м���˵����
2C(g)������2s����C��Ũ��Ϊ0.6mol��L-1���������м���˵����| A���٢� | B���٢� | C���ڢ� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) + H2O(g) ��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺
CH3OH(g) + H2O(g) ��H����187.4 kJ/mol��3000Cʱ�ĺ����ܱ������У���C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1��ʼ��Ӧ���������ͼ��ʾ���ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)��6H2O(g)��H����1025 kJ/mol������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����
4NO(g)��6H2O(g)��H����1025 kJ/mol������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����
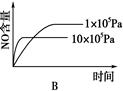
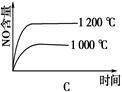
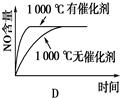
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NH4++NH2����NH4+��ƽ��Ũ��Ϊ1��10��15mol��L��1������˵���������(�� ��)
NH4++NH2����NH4+��ƽ��Ũ��Ϊ1��10��15mol��L��1������˵���������(�� ��)| A����Һ���м���NaNH2����ʹҺ�������ӻ���� |
| B����Һ���м���NH4Cl��Һ�������ӻ����� |
| C�����¶���Һ�������ӻ�KΪ1��10��30 |
| D����Һ���м�������ƿ�����NaNH2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
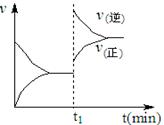
A��2SO2 (g)��O2 (g) 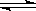 2SO3 (g) ����H��0 2SO3 (g) ����H��0 |
B��H2 (g)��I2 (g) 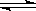 2HI (g) ����H��0 2HI (g) ����H��0 |
C��4NH3 (g)��5O2 (g) 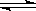 4NO(g)��6H2O (g) ����H��0 4NO(g)��6H2O (g) ����H��0 |
D��C (s)��H2O (g) 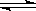 CO (g)��H2 (g) ����H��0 CO (g)��H2 (g) ����H��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com