
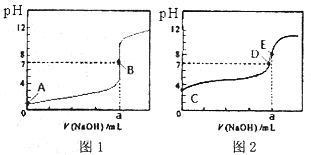
 �����£��� 0.1000mol/L NaOH ��Һ�ֱ�ζ� 20.00mL 0.1000mol/L HA ��Һ���ζ�����ͼ1����20.00mL 0.1000mol/L HB��Һ���ζ�����ͼ2��������˵����ȷ���ǣ�������
�����£��� 0.1000mol/L NaOH ��Һ�ֱ�ζ� 20.00mL 0.1000mol/L HA ��Һ���ζ�����ͼ1����20.00mL 0.1000mol/L HB��Һ���ζ�����ͼ2��������˵����ȷ���ǣ�������| A��ͼ1���Ա�ʾNaOH�ζ���������� |
| B��ͼ1��B��״̬ʱ����Һ���У�c��Na+��=c��A-�� |
| C���ﵽB��E״̬ʱ����Ӧ���ĵ�n��HA����n��HB�� |
| D����0mL��V��NaOH����20.00mLʱ����Ӧ�����Һ�и�����Ũ���ɴ�С��˳���Ϊc��A-����c��Na+����c��H+����c��OH-�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����0.1026mol?L-1������ζ�25.00mLδ֪Ũ�ȵ�����������Һ���ζ����յ�ʱ���ζ����е�Һ����ͼ1��ʾ����ʱ�Ķ���Ϊ
��1����0.1026mol?L-1������ζ�25.00mLδ֪Ũ�ȵ�����������Һ���ζ����յ�ʱ���ζ����е�Һ����ͼ1��ʾ����ʱ�Ķ���Ϊ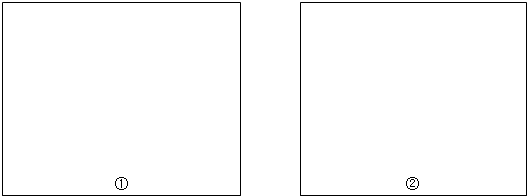
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�����ĵ���ʽ�� | ||||
B�����Ṥҵβ���е�SO2�ù����İ�ˮ���շ�Ӧ�����ӷ���ʽ��NH3?H2O+SO2�TNH
| ||||
C��4mol/LNaAlO2��Һ��3.5mol/LH2SO4��Һ�������Ϸ�Ӧ�����ӷ���ʽ��4AlO
| ||||
| D������0.25mol Ba��OH��2��ϡ��Һ��������ϡ���ᷴӦ���ų�akJ�����������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ�ǣ� Ba��OH��2��aq��+2HCl��aq���TBaCl2��aq��+2H2O��l������H=-4akJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��X��Ϊ��ѧ��ѧ�������ʣ�һ������������������ת����ϵ��������������ȥ��������˵��������ǣ�������
A��B��C��X��Ϊ��ѧ��ѧ�������ʣ�һ������������������ת����ϵ��������������ȥ��������˵��������ǣ�������| A����XΪCl2����C����ΪFeCl3 |
| B����XΪKOH��Һ����A����ΪAlCl3 |
| C����XΪO2����A��Ϊ���� |
| D����A��B��C��Ϊ��ɫ��Ӧ�ʻ�ɫ�Ļ������X����ΪCO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�22.4Lˮ�к���NA��ˮ���� |
| B��4�˽����Ʊ�ɸ�����ʱʧȥ�ĵ�����Ϊ0.2NA |
| C��50mL0.1mol/L H2SO4��Һ�к���H+��Ϊ0.005NA |
| D��2g �����к�2NA������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ʱ�����ӱ��� |
| B��ҡ�Ⱥ�������ƿ��ˮ���ڿ̶��ߣ��ټ�ˮ |
| C��������NaOH��Һ�������ձ��� |
| D��NaOH�����ܽ����Һδ����ȴ��������Һ������ƿ�в����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����ʯīΪ�缫���MgCl2��Һ��2Cl-+2H2O
| ||||
| B��NH4Clˮ��Һ�����ԣ�NH4++H2O�TNH3?H2O+H+ | ||||
| C��AlCl3��Һ��Ͷ�����Na��Al3++4Na+2H2O�TAlO2-+4Na++2H2�� | ||||
| D��FeBr2��Һ��ͨ������Cl2��2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��22.4 L��������к����ۼ���ĿΪ4NA |
| B��7.1 g Cl2��ȫ��Ӧ��ת�Ƶĵ�����һ��Ϊ0.1NA |
| C��1 mol/L��Na2CO3��Һ�к���2NA��Na+ |
| D��CO2��O2��ɵĻ�����к���NA�����ӣ�������ԭ����Ϊ2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com