
【题目】某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质不参与反应)。
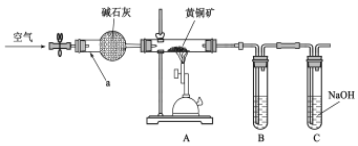
回答下列问题。
(1)仪器a的名称_________,碱石灰的作用______________________________________。
(2)为检验灼烧黄铜矿产生的气体,B中可选__________________
a.HNO3溶液 b.品红溶液 c.BaCl2溶液 d.溴水 e.KMnO4溶液
(3)C中NaOH的作用____________________________________________________
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀H2SO4反应生成Cu和CuSO4。
①请设计实验验证泡铜中含有Cu2O____________________________________________。
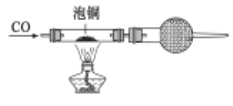
②用泡铜与CO反应来制取粗铜装置如下图,实验时依次进行的操作:
组装仪器→检查装置气密性→加装药品→____________→____________→…→尾气处理;CO还原Cu2O的化学方程式_______________________________________________
(5)为测定CuFeS2的纯度,称取a g黄铜矿样品充分灼烧,从灼烧产物中分离出泡铜,完全溶于稀硝酸,并配成200 mL的溶液,取20.00 mL该溶液用c mol· L-1的标准液EDTA(用H2Y2-表示)滴定至终点(标准液不与杂质反应),消耗EDTA V mL,则CuFeS2的纯度为____________。(滴定时的反应为:Cu2++H2Y2-===CuY2-+2H+)
【答案】(球形)干燥管 吸收通入空气中的二氧化碳和水蒸气 bde 吸收多余的SO2 取少量泡铜于试管中,加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O 通入气体 点燃酒精灯 CO+Cu2O![]() 2Cu+CO2
2Cu+CO2 ![]()
【解析】
空气通过球形干燥管除掉二氧化碳和水蒸气,酒精喷灯高温灼烧装置A,CuFeS2被氧气氧化,B装置用来检验灼烧黄铜矿产生的气体二氧化硫,C装置吸收多余的SO2,防止污染环境。
(1)仪器a的名称球形干燥管,碱石灰的作用吸收通入空气中的二氧化碳和水蒸气;
答案:球形干燥管 吸收通入空气中的二氧化碳和水蒸气
(2)灼烧黄铜矿产生的气体是二氧化硫;
a.HNO3溶液可以氧化二氧化硫,但是可能没有明显的现象,且会产生不能被氢氧化钠溶液吸收的污染性气体NO,故不选a;
b.二氧化硫气体可以漂白品红溶液,故选b;
c.二氧化硫气体不与BaCl2溶液反应,故不选C;
d.二氧化硫与溴可发生氧化还原反应,使溴水褪色,故选d
e.二氧化硫与KMnO4溶液可发生氧化还原反应,使酸性高锰酸钾褪色,故选e;
答案:bde
(3)C中NaOH是用来吸收多余的二氧化硫气体,防止污染环境;
答案:吸收多余的SO2
(4)①因为铜排在氢后面,不与稀硫酸反应,而Cu2O能与稀H2SO4反应生成Cu和CuSO4,所以可以用稀硫酸验证;
答案:取少量泡铜于试管中,加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O
②实验开始之前先除掉装置中的空气,再加热,否则CO与空气混合加热可能会引起爆炸;因此步骤:组装仪器→检查装置气密性→加装药品→通入气体→点燃酒精灯→…→尾气处理;CO还原Cu2O的化学方程式CO+Cu2O![]() 2Cu+CO2;
2Cu+CO2;
答案:通入气体 点燃酒精灯CO+Cu2O![]() 2Cu+CO2
2Cu+CO2
(5)根据关系式进行计算:
CuFeS2 ~ Cu2+ ~ H2Y2-
1mol 1mol 1mol
n(CuFeS2) cV×10-3×![]()
得:n(CuFeS2)=cV×10-2mol
纯度为:![]() =
=![]()
答案:![]()


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是![]()

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:![]()
B.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
C.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
D.当三种酸均滴定至![]() 时,HZ所用NaOH溶液体积最小
时,HZ所用NaOH溶液体积最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
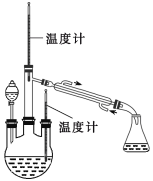
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
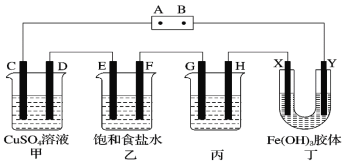
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂污水中含CN-,现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
(5)装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:①工作一段时间后A槽pH值上升,B槽的pH下降。②b、c两极上反应的离子的物质的量相等。应选择的电解质是( )

A.A槽NaOH溶液;B槽CuSO4溶液
B.A槽AgNO3溶液;B槽CuCl2溶液
C.A槽Na2SO4溶液;B槽AgNO3溶液
D.A槽NaCl溶液;B槽AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 | 测得pH=3.2 | NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
D | 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色ZnS沉淀,后产生黑色CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )
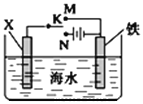
A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1 mol C能与2 mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同。D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B、E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A_____________、B_____________、C_____________、D_____________、E_____________。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是__________ (填字母序号,下同),生成二氧化碳最多的是__________。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是__________ (填字母序号,下同),生成水最少的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com