

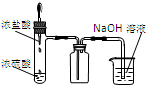
| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 导气管末端不应该伸入到液面以下 | |
| D. | 若将装置Ⅰ中Na2SO3改成NaOH溶液,现象完全相同 |
分析 Na2SO3是强碱弱酸盐,SO32-水解导致溶液呈碱性,Cl2具有强氧化性,能将Na2SO3氧化生成Na2SO4,自身被还原生成氯离子,氯气有毒,不能直接排空,要用碱液吸收.
解答 解:A.Cl2具有强氧化性,能将Na2SO3氧化生成Na2SO4,自身被还原生成氯离子,所以通入Cl2后,装置Ⅰ中发生了氧化还原反应,故A正确;
B.Cl2具有强氧化性,能将Na2SO3氧化生成Na2SO4,自身被还原生成氯离子,所以通入Cl2后,装置Ⅰ中发生了氧化还原反应,离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,故B正确;
C.氯气极易溶于氢氧化钠溶液,导气管末端不应该伸入到液面以下,不则达不到防上倒吸,故C正确;
D.若将装置Ⅰ中Na2SO3改成NaOH溶液,氯气与氢氧化钠反应生成氯化钠和次氯酸钠的混合溶液,溶液呈碱性,所以装置Ⅰ中溶液始终呈红色,现象不完全相同,故D错误;
故选D.
点评 本题考查氯气及亚硫酸盐性质,明确氯气的强氧化性及次氯酸的漂白性即可解答,注意次氯酸和二氧化硫漂白原理的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
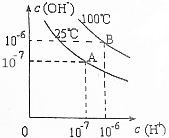
| A. | 25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,所得溶液的pH等于7 | |
| B. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH小于7 | |
| C. | 100℃时,pH=12的NaOH溶液aL和pH=2的H2SO4溶液bL恰好中和,则a:b=1:1 | |
| D. | 100℃时,pH=12的NaOH溶液和pH=9的NaOH溶液等体积混合,所得溶液的pH约为11.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 | B.装置可除去CO2中含有的少量HCl | C.装置可制备氨气 | D.装置可制取、收集并吸收多余的HCl |
 | 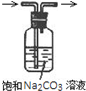 | 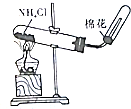 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
一种回收并利用含碘(I-)废液的工艺流程如下: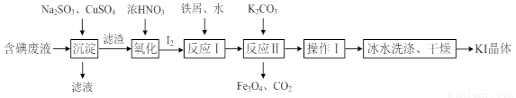
(1)“沉淀”中生成CuI的离子方程式为___________________。
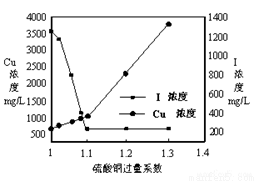
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_____________,分析原因_________________。
(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是________________,反应Ⅱ的化学方程式是_________________________。
(4)操作Ⅰ包括____________,冰水洗涤的目的是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 | |
| D. | 改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com