
| A. | C2H2、C6H6 | B. | C2H4、C2H6O | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
分析 X、Y无论以何种比例混合,只要总物质的量不变,完全燃烧时,二者耗氧量相同,则X、Y两化学式相差一个或若干个“CO2”基团或“H2O”基团,符合CxHy(CO2)n,或CxHy(H2O)n,可利用分子式的拆写法判断.
解答 解:A、C2H2、C6H6二者最简式相同,二者物质的量比值不同,耗氧量也不同,故A错误;
B、CH4、C2H4O2含有的H数目相同,在分子组成上相差1个“CO2”基团,只要其物质的量之和不变,完全燃烧时耗氧气量不变,故B正确;
C、CH2O、C3H6O2含有的C数目不同,二者物质的量比值不同,耗氧量不同,故C错误;
D、CH4、C2H4O2含有的H数目相同,在分子组成上相差1个“CO2”基团,只要其物质的量之和不变,完全燃烧时耗氧气量不变,故D正确;故选BD.
点评 本题考查有机物的推断,题目难度不大,注意有机物分子式的确定方法,要求学生具有分析和解决问题的能力.


科目:高中化学 来源: 题型:选择题

| A. | 反应前后各元素的化合价均不变 | |
| B. | 水煤气的成分是一氧化碳和氧气 | |
| C. | 该反应中含氢元素的化合物有3种 | |
| D. | 该反应的化学方程式中甲烷和水的计量数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L Cl2溶于水,转移的电子数目小于 NA | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3 NA | |
| C. | 0.1 moI•L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA | |
| D. | 乙烯和聚乙烯组成的14 g混合物中原子总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )
mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )| A. | m+n>p | B. | x点的速率关系为v正>v逆 | ||
| C. | n>p | D. | x点比y点混合物反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
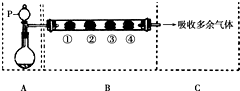 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘 水混合液 | 氢硫酸 |
| 现象 | a | b | 褪色 | 浅黄色 |
| 体现SO2的性质 | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com