
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
(1)Ⅰ.把氯气缓慢通入紫色石蕊溶液中,可以观察到的现象是: . 请你解释其中的原因 .
(2)Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.①其反应原理为:(用化学方程式表示) .
②实验室配制好4.0molL﹣1的NaOH溶液,这种溶液mL才能与2.24L氯气(标准状况)恰好完全反应.
③配制250mL 4.0molL﹣1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量
b.称量氢氧化钠固体
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氢氧化钠固体,静置冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
①用天平称量的所需氢氧化钠固体的质量是g.
②上述步骤的正确操作顺序是 .
③上述实验需要的玻璃仪器有 .
【答案】
(1)紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去);Cl2+H2O?HCl+HClO,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液
(2)Cl2+2NaOH=NaCl+NaClO+H2O;50;40.0;a b d c f e;烧杯、玻璃棒、胶头滴管、250mL容量瓶
【解析】解:(1)Ⅰ.氯气与水反应发生Cl2+H2O═HCl+HClO,具有酸性和漂白性,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液,则氯气通入紫色石蕊溶液中,可以观察到的现象是紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去),所以答案是:紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去);Cl2+H2OHCl+HClO,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液;(2)Ⅱ.①氯气与NaOH溶液反应制备漂白液,反应原理为Cl2+2NaOH═NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH═NaCl+NaClO+H2O;②由反应Cl2+2NaOH═NaCl+NaClO+H2O可知,n(NaOH)=2n(Cl2)=2× ![]() =0.2mol,则V=
=0.2mol,则V= ![]() =0.5L=50mL,所以答案是:50 ③①n(NaOH)=0.25L×4.0molL﹣1=1.0mol,m(NaOH)=1.0mol×40gmol﹣1=40g,所以答案是:40g;②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,则正确的顺序为a、b、d、c、f、e,所以答案是:a、b、d、c、f、e;③由上述实验步骤可知,需要的仪器为托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶、药匙,所以需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,所以答案是:烧杯、玻璃棒、胶头滴管、250mL容量瓶.
=0.5L=50mL,所以答案是:50 ③①n(NaOH)=0.25L×4.0molL﹣1=1.0mol,m(NaOH)=1.0mol×40gmol﹣1=40g,所以答案是:40g;②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,则正确的顺序为a、b、d、c、f、e,所以答案是:a、b、d、c、f、e;③由上述实验步骤可知,需要的仪器为托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶、药匙,所以需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,所以答案是:烧杯、玻璃棒、胶头滴管、250mL容量瓶.
【考点精析】根据题目的已知条件,利用氯气的化学性质和配制一定物质的量浓度的溶液的相关知识可以得到问题的答案,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
已知:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
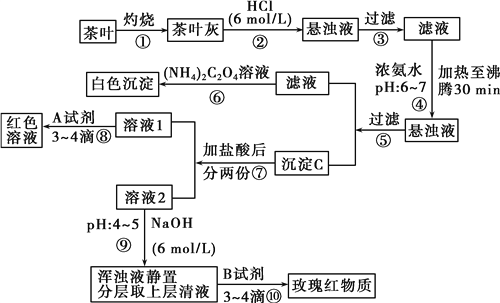
请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是________________。
(2)写出检验Ca2+的离子方程式__________________________。
(3)写出沉淀C所含主要物质的化学式________________________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式__________________________。
(5)步骤⑨的作用是_____________________________________。
(6)称取400 g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12 g沉淀,原茶叶中钙元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为从铝土矿(Al2O3、Fe2O3、泥沙)提取铝的流程图(注:整个流程中,不考虑泥沙的溶解及有关反应;C可以用来治疗胃酸过多):
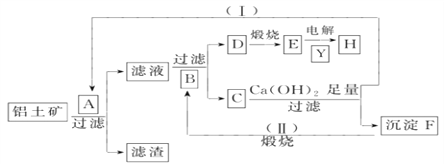
(1)A溶质的化学式___________;B的结构式____________,Y的名称_____________。
(2)写出①C与Ca(OH)2稀溶液反应的离子方程式: __________________________________。
②F→B的反应方程式: ______________________________。
(3)操作(Ⅰ)、(Ⅱ)在工业生产中的意义________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023 , 则此时在阴极上析出铜的质量是( )
A.8g
B.16g
C.32g
D.64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将wg镁粉和铝粉的混合物溶于足量的盐酸中,再和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热灼烧,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
A.30%
B.40%
C.50%
D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
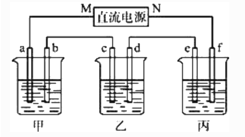
接通电源,经过一段时间后,测得丙中K2SO4的质量分数变为10.47%,乙中c电极质量增加。
①电源的N端为________极;
②电极b上发生的电极反应式为___________________________________________;
③电极b上生成的气体在标准状况下的体积___________L;
④电极c的质量变化是________g;
⑤电解前后溶液的pH保持不变的是________。
A.甲溶液 B.乙溶液 C.丙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述不正确的是
A. 锌片作负极 B. 铜片作正极,铜得到电子
C. 锌发生氧化反应 D. 氢离子在铜片表面被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com