
(1)�������ʸ�����Ӧ���������ܸ�KSCN��Һ�������ɺ�ɫ��Һ���ǣ� ��
A.���� B.���� C.CuSO4��Һ D.ϡ����
(2)���������ԣ����л�ԭ�Ե����ǣ� ��
A.Fe B.Fe2+ C.Fe3+
(3)�ѹ��������ۼ���ϡ�����У������ǣ� ��
A.����Ӧ B.��������� C.������������
(4)Ҫ��ȥFeCl2��Һ�е�����FeCl3�����еİ취�ǣ� ��
A.����KSCN��Һ B.ͨ������
C.����ͭ�� D.��������
(5)������ȱ��ʱ��������Ҫ�Բ�������Ʒ�������ܹ����յ���+2����Ԫ�ء�����+2����Ԫ�غ����ױ��������鿴һ�ֲ�������Ʒ���˽�������Ԫ�صļ�̬��
������Ϊ���Բ���ʲô�������鲹��������Ԫ�صļ�̬��
����ȻʳƷ�к��еĴ����+3����Ԫ�أ�Ϊ��ʹ+3����Ԫ��ת��Ϊ+2����Ԫ�ز�������Ϻõ����գ�����ΪӦ�ò�ȡ��Щ��ʩ����������ϣ�Ѱ�Ұ취��
˼·�㲦��(1)�������ᡢϡ���ᡢCuSO4��Һ��Ӧ��õ�+2�������ӣ�����������Ӧ����FeCl3��FeCl3��KSCN��ˮ��Һ�з���Fe3++SCN-![]() ��Fe(SCN)��2+(��ɫ)��ѡB��
��Fe(SCN)��2+(��ɫ)��ѡB��
(3)�ڹ������۴��������£���������Fe3+����ΪFe+2Fe3+====3Fe2+����Һ����Ԫ�صĴ�����ʽֻ������Fe2+����ΪC��
(4)���ӵ�ԭ���ǣ���ȥ���ʶ��������µ����ʡ�������KSCN��Һ�����ܳ�ȥFe3+��������K+��SCN-���������ӣ�Aѡ���ȷ��ͨ��������������Ӧ��2FeCl2+Cl2====2FeCl3�����������⣬Bѡ���ȷ������ͭ�ۣ�Cu+2Fe3+====Cu2++2Fe2+����Һ��������Cu2+���÷������������ۣ�Fe+2Fe3+====3Fe2+���÷������С���ΪD��
(5)�ټ�����Ԫ�صļ�̬�����Կ����ȹ۲���ˮ��Һ��ɫ�ķ�������Fe2+����ҺΪdz��ɫ����Fe3+����ҺΪ�ػ�ɫ��Ȼ������ú�NaOH��Һ��Ӧ��KSCN��Һ��Ӧ�۲������ɫ�ķ���������飺Fe2+��NaOH���ɲ��ȶ��İ�ɫ����Fe(OH)2���ð�ɫ������¶�ڿ����л�Ѹ��ת��ɻ���ɫ������Ϊ���ɫ����Fe(OH)3,Fe2+��KSCN��Һ����û����ɫ�仯����Fe3+��NaOH��Һֱ�����ɺ��ɫ����Fe(OH)3����KSCN��Һ���óʺ�ɫ��
��Ϊʹ��Ԫ�ر�����Ϻõ����գ���Ҫ��+3����Ԫ�ػ�ԭΪ+2����Ԫ�ء����Կ��Ǽӻ�ԭ�������û�ԭ����������彡�����������Fe�ۡ�
�𰸣�(1)B (2)B (3)C (4)D
(5)�ټ����� �������Fe�ۣ����뻹ԭ����


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʡ����һ�С����и�����ѧ����ĩ������ѧ�Ծ����������� ���ͣ������
���û�ѧ��Ӧԭ���о��⡢�����ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ����
��1����֪��25��ʱKSP��AgCl��=1.6��l0��10 KSP��AgI��=1.5��l0��16
��ˮ�к��д�����Ԫ�أ�����Ԫ�����ȣ���Ԫ����⣬���ں�ˮ�о��Ի���̬���ڡ���25���£���0.1L0.002mol��L��l��NaCl��Һ�м���0.1L0.002mol��L��l��������Һ���а�ɫ�������ɣ�����������ԭ���ǣ�ͨ������ش� ����Ӧ��Ļ���Һ�м�������0.1L0.002mol��L��1��NaI��Һ�������������� �������������ԭ���ǣ������ӷ���ʽ��ʾ�� ��
��2������������Ʊ������ܶ࣬���з�����ԭ����������ߵ��� ������ţ���
A��BaO2 + H2SO4�� BaSO4 �� + H2O2
B��2NH4HSO4 (NH4)2S2O8 + H2��
(NH4)2S2O8 + H2��
(NH4)2S2O8 + 2H2O �� 2NH4HSO4 + H2O2
C��CH3CHOHCH3 + O2�� CH3COCH3 + H2O2
D���һ�����������ͼ
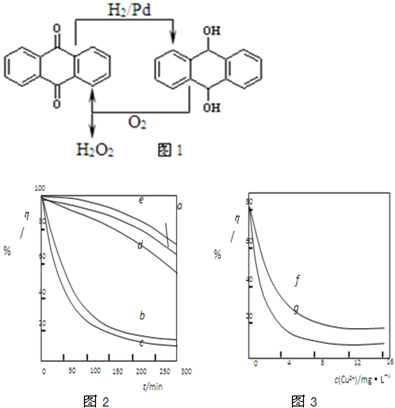
��3��ij���ױ����˲�ͬ�������Ӽ���Ũ�ȶ�˫��ˮ�������⺣��������Һ��Ӧ���ʵ�Ӱ�죬ʵ������ͼ1��ͼ2��ʾ��
ע������ʵ������¶�Ϊ20�桢w(H2O2)��0.25%��pH��7.12������������ҺŨ��Ϊ8mg��L�D1�������½��С�ͼ1������a��H2O2��b��H2O2+Cu2+��c��H2O2+Fe2+��d��H2O2+Zn2+��e��H2O2+Mn2+��ͼ2������f����Ӧʱ��Ϊ1h��g����Ӧʱ��Ϊ2h����ͼ�е��������������������Һ��ճ�ȣ���������Ũ������Һճ������أ���
��������Ϣ��֪����������������� ������ţ���
A����������ʹ�ý��ⷴӦ���ʼ���
B���������ӶԸý��ⷴӦ�Ĵ�Ч�ʱ�ͭ���ӵ�
C������������Һճ�ȵı仯�����ɷ�ӳ���併�ⷴӦ���ʵĿ���
D��һ�������£�ͭ����Ũ��һ��ʱ����Ӧʱ��Խ��������������ҺŨ��ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и���5��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ������
���仯��������Ȼ���й㷺���ڣ��������
ԭ���ش��������⣺
��1����ͼ��ʾһ���¶��£������Ϊ10L���ܱ������г���1molO2��һ������SO2��SO2��SO3(g)��Ũ����ʱ��仯�������
�ٸ��¶��£��ӷ�Ӧ��ʼ��ƽ��ʱ������ƽ����Ӧ������ ��
�ڸ��¶��£���Ӧ2SO2(g)+O2(g) 2SO3(g)��ƽ�ⳣ��Ϊ ��
��2���Ի�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ�ϣ������ա�������ʹ��Ԫ�ؼ������й����ʽ���¯������ͭԪ�ػ�ԭΪͭ����������Ҫ��ӦΪ��
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) ��H =-768.2 kJ��mol��1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) ��H =+116.0 kJ��mol��1
�١����ա�ʱ��ͨ����������ʹ��ͭ���������ɱ�ɰ����Ҫ�ɷ���Cu2S��FeS�������ʵ�����Ϊ1:2����SO2���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
���������У�Cu2S������ʵ�����O2��Ӧ����Cu���Ȼ�ѧ����ʽΪ�� ��
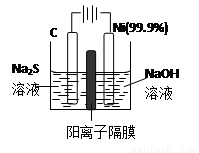
��3���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�
��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe�����������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ�����ڵ����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�긣��ʡ�����и�����ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ������
���û�ѧ��Ӧԭ���о��⡢�����ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ����
��1����֪��25��ʱKSP��AgCl��=1.6��l0��10 KSP��AgI��=1.5��l0��16
��ˮ�к��д�����Ԫ�أ�����Ԫ�����ȣ���Ԫ����⣬���ں�ˮ�о��Ի���̬���ڡ���25���£���0.1L0.002mol��L��l��NaCl��Һ�м���0.1L0.002mol��L��l��������Һ���а�ɫ�������ɣ�����������ԭ���ǣ�ͨ������ش� ����Ӧ��Ļ���Һ�м�������0.1L0.002mol��L��1��NaI��Һ�������������� �������������ԭ���ǣ������ӷ���ʽ��ʾ�� ��
��2������������Ʊ������ܶ࣬���з�����ԭ����������ߵ��� ������ţ���
A��BaO2 + H2SO4�� BaSO4 �� + H2O2
B��2NH4HSO4 (NH4)2S2O8 +
H2��
(NH4)2S2O8 +
H2��
(NH4)2S2O8 + 2H2O �� 2NH4HSO4 + H2O2
C��CH3CHOHCH3 + O2�� CH3COCH3 + H2O2
D���һ�����������ͼ

��3��ij���ױ����˲�ͬ�������Ӽ���Ũ�ȶ�˫��ˮ�������⺣��������Һ��Ӧ���ʵ�Ӱ�죬ʵ������ͼ1��ͼ2��ʾ��

ע������ʵ������¶�Ϊ20�桢w(H2O2)��0.25%��pH��7.12������������ҺŨ��Ϊ8mg��L�D1�������½��С�ͼ1������a��H2O2��b��H2O2+Cu2+��c��H2O2+Fe2+��d��H2O2+Zn2+��e��H2O2+Mn2+��ͼ2������f����Ӧʱ��Ϊ1h��g����Ӧʱ��Ϊ2h����ͼ�е��������������������Һ��ճ�ȣ���������Ũ������Һճ������أ���
��������Ϣ��֪����������������� ������ţ���
A����������ʹ�ý��ⷴӦ���ʼ���
B���������ӶԸý��ⷴӦ�Ĵ�Ч�ʱ�ͭ���ӵ�
C������������Һճ�ȵı仯�����ɷ�ӳ���併�ⷴӦ���ʵĿ���
D��һ�������£�ͭ����Ũ��һ��ʱ����Ӧʱ��Խ��������������ҺŨ��ԽС
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com