
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
① 请结合上表数据,写出NO与活性炭反应的化学方程式 。
② 上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= ,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96 L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为 ,
所得溶液中离子浓度由大到小的顺序为 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。现将浓度为2×10—4mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为 。
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生
反应为 ,则b电极的电
,则b电极的电
极反应式为 。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,溶液中始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
甲酸甲酯水解反应方程式为:
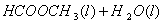 ≒
≒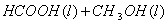
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:

甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为: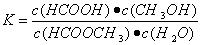 ,则该反应在温度
,则该反应在温度
T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列四个图像的说法中正确的是( )

A. 图①t1时改变的条件可能是升高了温度或增大了压强
B. 图②该微粒仅为18O2-不能为16O2-
C. 图③若A为CaO,则B可能为MgO
D. 图④中的ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学反应与能量的说法正确的是
A.任何化学反应都伴随有能量变化
B.ΔH>0表示放热反应,ΔH<0表示吸热反应
C.化学键的断裂会放出能量
D.反应物总能量比生成物总能量高的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是
A.电子从原电池的负极通过导线移向正极
B.电子从原电池的正极通过导线移向负极
C.阴离子在电解质溶液中向正极移动
D.阳离子在电解质溶液中向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1HClO溶液所得滴定曲线如下图。下列说法正确的是

A.点①所示溶液中:c(ClO-)+c(OH-)=c(HClO)+c(H+)
B.点②所示溶液中:c(Na+)=c(HClO)+c(ClO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(ClO-)>c(H+)
D.滴定过程中可能出现:c(HClO)>c(ClO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
(1) 若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=200 mL时,则金属粉末中,n(Mg)=_________mol,V2=__________mL。
(2) 若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为__________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com