
| A. | X、Y、Z既能形成离子化合物.又能形成共价化合物 | |
| B. | Y和Z元素的原子半径大小顺序为Y>Z | |
| C. | X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z | |
| D. | Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W |
分析 X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,在元素周期表中,Z与Y、W均相邻,Y、Z、W三种元素的原子最外层电子数之和为17,若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: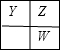 、
、 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,据此解答.
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,据此解答.
解答 解:X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,在元素周期表中,Z与Y、W均相邻,Y、Z、W三种元素的原子最外层电子数之和为17,若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: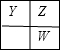 、
、 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,
A.X、Y、Z可形成的化合物可为HNO3或NH4NO3等,前者为共价化合物,后者为离子化合物,故A正确;
B.Y、Z位于同一周期,同周期元素从左到右原子半径逐渐减小,则原子半径大小顺序为:Y>Z,故B正确;
C.H与N、O元素之间形成的核外电子总数为10的微粒有NH3、NH4+、OH-、H2O、H3O+等,故C错误;
D.Z、W分别为O、S元素,其氢化物分别为水、硫化氢,非金属性越强,氢化物稳定性越强,且水分子之间存在氢键,则二者最简单氢化物的沸点和稳定性均为H2Z>H2W,故D正确;
故选C.
点评 本题考查结构性质位置关系应用,为高考常见题型,题目难度不大,推断元素为解答关键,注意把握原子结构特点以及元素在周期表中的位置,试题侧重于学生的分析能力的考查.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
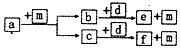 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | 阴离子的还原性:Y>W | |
| C. | 图中物质的转化过程均为氧化还原反应 | |
| D. | a一定由W、X两种元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰蒸发要吸收大量的热,这不是化学反应中的吸热现象 | |
| B. | 酒精常被用作酒精灯和内燃机中的燃料,说明酒精燃烧是放热反应 | |
| C. | 木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 | |
| D. | 人们用氢氧焰焊接金属,主要是利用了氢气和氧气化合时所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 反应物X和Y的总能量一定大于生成物M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:
将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(稀) | B. | N2+O2 | C. | NH4Cl+O2 | D. | NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①使用催化剂,能降低该反应的活化能 | |
| B. | 反应②为吸热反应 | |
| C. | 反应③将化学能转化为光能 | |
| D. | 反应CO(g)+H2O(g)═CO2(g)+H2(g);△H=-82.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
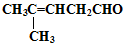 检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为
检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为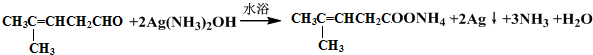 或
或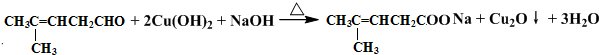 ;
;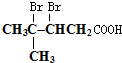 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com