
| 选项 | 实验操作和现象 | 结论 |
| A | 将气体X分别通入溴水和酸性高锰酸钾溶液中,两溶液均褪色 | 气体X一定是C2H4 |
| B | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32--强 |
| C | 向某溶液中先滴加少量氯水,再滴加2滴KSCN溶液,溶液变成血红色 | 原溶液中一定含有Fe2+ |
| D | 将H2S气体通入浓度均为0.01mol•L-l的ZnSO4和CuSO4混合溶液中,先出现CuS黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.能使溴水和酸性高锰酸钾溶液都褪色的气体不一定为乙烯;
B.向NaAlO2溶液中滴入NaHCO3溶液,生成氢氧化铝、碳酸钠;
C.试剂滴加顺序错误;
D.先出现CuS黑色沉淀,说明CuS更难溶于水.
解答 解:A.能使溴水和酸性高锰酸钾溶液都褪色的气体不一定为乙烯,也可能为二氧化硫、乙炔等气体,故A错误;
B.向NaAlO2溶液中滴入NaHCO3溶液,生成氢氧化铝、碳酸钠,则AlO2-结合H+的能力比CO32-强,故B正确;
C.检验亚铁离子,应先加入KSCN,再低价氯水,以排除铁离子的干扰,故C错误;
D.先出现CuS黑色沉淀,说明CuS更难溶于水,则Ksp(CuS)<Ksp(ZnS),故D正确.
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象、实验结论为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:实验题
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 银氨溶液中滴加过量的盐酸:Ag(NH3)2++2H+═Ag++2NH4+ | |
| C. | 过量的铁粉与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
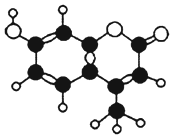 可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )
可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )| A. | ①③⑤ | B. | ③④⑤ | C. | ③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com