
【题目】在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是 ( )
A. 3∶2 B. 2∶1 C. 1∶1 D. 2∶3
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释不合理的是( ) 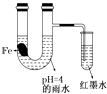
A.生铁片中所含的碳能增强铁的抗腐蚀性
B.雨水酸性较强,生铁片开始发生析氢腐蚀
C.导管内墨水液面回升时,正极反应式:O2+2H2O+4e﹣═4OH﹣
D.随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( ) 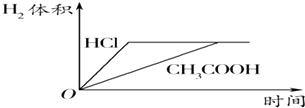
A.加水稀释至溶液体积为200mL,醋酸溶液的pH变为4
B.温度都升高20°C后,两溶液的pH不再相等
C.加水稀释至溶液体积为200mL后,两种溶液中c(OH﹣)都减小
D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色. 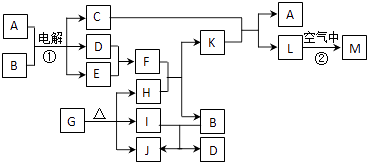
(1)基于反应①原理的化学工业称为 , 写出该反应的化学方程式 .
(2)写出K和E反应的离子方程式 . 写出F溶液和H反应的离子方程式 .
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100 0molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应 , 判断滴定终点的现象是 .
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.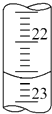
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质
B.pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n
C.常温下,在0.10 molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3H2O)的值增大
D.常温下,CH3COOH的Ka=1.7×10﹣5 , NH3H2O的Kb=1.7×10﹣5 , CH3COOH溶液中的c(H+)与NH3H2O的溶液中的c(OH﹣)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中投入物质A和物质B在适宜的条件下发生反应:A(s)+2B(g)2C(g)+D(g)
(1)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示.
则T1T2(填“>”、“<”或“=”),该反应的正反应的△H0(填“>”、“<”或“=”).
(2)若该反应的逆反应速率与时间的关系如图2所示: 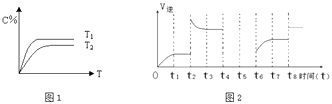
①由图可见,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,则t8时改变的条件是 .
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com