
A、一种镁电池的反应式为XMg+Mo3S4
| |||
| B、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O | |||
| C、在甲、乙两个体积不变且相同的密闭容器中发生反应A(g)+2B(g)?2C(g),初始条件均为:常温,A、B两气体各1mol.甲容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%,乙容器中的反应在200℃时达平衡,若此时气体A的体积分数为35% 则说明该反应是放热反应 | |||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200 kJ?mol-1 |
| 1-x+1-2x+2x |
| 2 |
| 0.6 |
| 1.6 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、水分子可表示为H-O-H,分子中键角为180. |
| C、H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时消耗能量为2×463KJ |
| D、元素周期表中的第ⅠA族和第ⅦA族元素的原子间可以形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 75℃ | - | - | 1mL | 100s |
| 2 | 75℃ | 10滴 | - | 1mL | 40s |
| 3 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量,将产生的气体通入 . | |
| 步骤2:向步骤1得到的溶液中滴加几滴. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
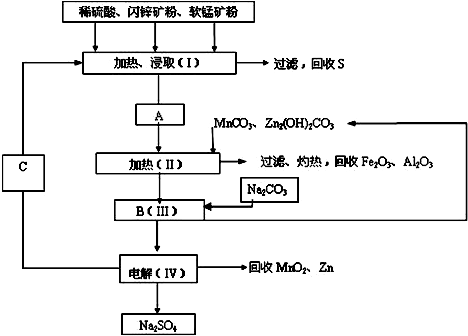
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定不含Fe3+和Fe2+ |
| B、溶液可能含有AlO2- |
| C、溶液可能含有NO3- |
| D、可能含有Fe3+但一定不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、导致易拉罐变瘪的反应是:CO2+2OH-=CO32-+H2O |
| B、导致易拉罐又鼓起来的反应是:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| C、取易拉罐内反应后的溶液,逐滴加入足量的盐酸,只能发生3个化学反应 |
| D、如果将CO2换为NH3,浓NaOH溶液换为浓盐酸,易拉罐也会出现先瘪后鼓的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com