
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,不能使蒸发皿中的水分完全蒸干后才停止加热 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
分析 A.蒸馏时,测定馏分的温度;
B.蒸发时,利用余热加热;
C.萃取时,萃取剂与原溶剂不溶、不发生反应,不需要考虑密度;
D.分液时,避免液体混合.
解答 解:A.蒸馏时,测定馏分的温度,则应使温度计水银球靠近蒸馏烧瓶的支管口处,故A正确;
B.蒸发时,利用余热加热,则不能使蒸发皿中的水分完全蒸干后才停止加热,故B正确;
C.萃取时,萃取剂与原溶剂不溶、不发生反应,不需要考虑密度,密度可比水的密度大或小,故C错误;
D.分液时,避免液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验操作为解答的关键,侧重分析与应用能力的考查,注意实验评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | a+2b-c | B. | a+b-2c | C. | 2a+2b-c | D. | a+2b-2c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
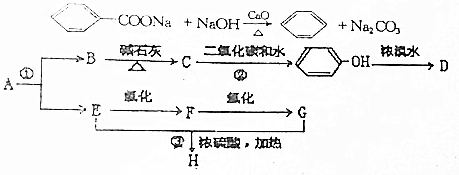
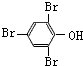 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.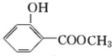 ,
,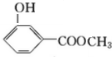 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 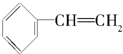 | B. | 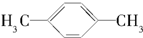 | C. | 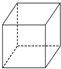 | D. | 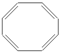 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、CO32-、NO3- | B. | Na+、OH-、K+、MnO4- | ||
| C. | K+、HCO3-、SO42-、Na+ | D. | H+、Cl-、Cu2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com