
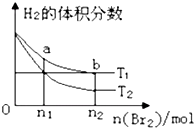
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、由图可知:T2>T1 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3能与NaOH溶液反应,则Al(OH)3也能与氨水反应 |
| B、过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂 |
| C、Fe(OH)3溶于氢碘酸的离子方程式为Fe(OH)3+3H+═Fe3++3H2O |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 评价 |
| A | H+、Mg2+、Br-、NO3- | 能大量共存于同一溶液中,投入少量锌粉后,可放出H2 ,反应的离子方程式为 Zn+2H+=Zn2++H2↑ |
| B | NH4+、CO32-、Cl-、Al3+ | 不能大量共存于同一溶液中,因为有沉淀生成 2Al3++3CO32-=Al2(CO3)3↓ |
| C | ClO-、Na+、K+、HSO3- | 能大量共存于同一溶液中 |
| D | HCO3-、OH-、Na+、K+ | 不能大量共存于同一溶液中,因为发生如下反应 HCO3-+OH-=CO32-+H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为负极,MnO2为正极 |
| B、Zn为正极,MnO2为负极 |
| C、工作时电子由MnO2经外电路流向Zn极 |
| D、Zn电极发生还原反应,MnO2电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| A、C-H键键长小于H-H键 |
| B、甲烷的燃烧热为b kJ?mol -1 |
| C、2CH3OH(g)=2CH4(g)+O2(g)△H=2(a-b) kJ?mol-1 |
| D、当甲醇和甲烷物质的量之比为l:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为c kJ,则该混合物中甲醇的物质的量为c/(a+2b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com