
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
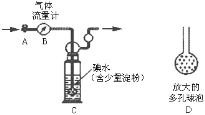
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:_________。
(2)洗气瓶C中的溶液可以酸性高锰酸钾溶液替代,请写出离子方程式:________。
(3)本实验的关键在于关闭气体流量计的时机,应当在什么时候关闭活塞A____________
乙方案:实验步骤如以下流程图所示:
![]()
(4)写出步骤①中反应的化学方程式_________。
(5)如何判断步骤②中沉淀是否完全的方法___________。
(6)经测定当通过的尾气体积为67.2L(已换算成标准状况)时,最终得到固体质量为4.66g,则该尾气中二氧化硫含量(体积分数)为__________(保留到0.01%)
丙方案:将乙中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案________(填是或否)合理,说明理由:___________
【答案】增大气体与溶液的接触面积,有利于二氧化硫与碘水充分反应 ![]() 当洗气瓶C中溶液蓝色消失时
当洗气瓶C中溶液蓝色消失时 ![]() 静置后,往上层清液加入Ba(OH)2,如未出现白色沉淀,则沉淀完全 0.67% 不合理 BaSO3被部分氧化为BaSO4
静置后,往上层清液加入Ba(OH)2,如未出现白色沉淀,则沉淀完全 0.67% 不合理 BaSO3被部分氧化为BaSO4
【解析】
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积加快反应;
(2)二氧化硫与酸性高锰酸钾溶液发生氧化还原反应,据此写离子方程式;
(3)碘水消耗完全时,蓝色消失,此时关闭活塞A;
(4)H2O2具有氧化性,会将SO2完全转化为SO42-;
(5)根据判断沉淀是否完全的方法作答;
(6)根据最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量;
(7)将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,BaSO3被部分氧化为BaSO4,导致测定的亚硫酸钡的质量偏大,据此分析。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应,故答案为:增大气体与溶液的接触面积,有利于二氧化硫与碘水充分反应;
(2)二氧化硫能使酸性高锰酸钾溶液褪色,反应方程式为: ![]() ,故答案为:
,故答案为:![]() ;
;
(3)通过洗气瓶C中溶液颜色进行判断,蓝色消失时,及时关闭活塞A,故答案为:当洗气瓶C中溶液蓝色消失时;
(4)H2O2具有氧化性,会将SO2完全转化为SO42-,方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)判断沉淀是否完全的方法:静置后,往上层清液加入Ba(OH)2,如未出现白色沉淀,则沉淀完全,故答案为:静置后,往上层清液加入Ba(OH)2,如未出现白色沉淀,则沉淀完全;
(6)4.66g是硫酸钡的质量,硫酸钡的物质的量为n(BaSO4)=![]() mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)=
mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)=![]() mol×22.4L/mol=0.448L,故尾气中二氧化硫的体积分数是
mol×22.4L/mol=0.448L,故尾气中二氧化硫的体积分数是![]() 0.67%,故答案为:0.67%;
0.67%,故答案为:0.67%;
(7)将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,BaSO3被部分氧化为BaSO4,导致测定的亚硫酸钡的质量偏大,测定二氧化硫的体积偏大,体积分数偏大,故不合理,故答案为:不合理;BaSO3被部分氧化为BaSO4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
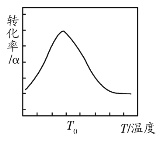
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式中正确的有()
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2=2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2=2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-=Fe(OH)3↓
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠
A. ④③②①B. ①④③②C. ②③④①D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
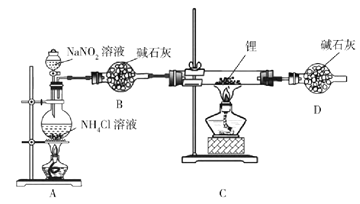
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
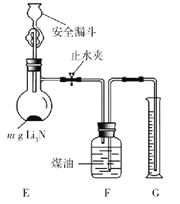
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
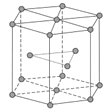
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。
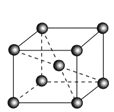
(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体电解质可以通过离子迁移传递电荷,利用固体电解质RbAg4I5可以制成电化学气敏传感器,其中迁移的物种全是Ag+。下图是一种测定O2含量的气体传感器示意图,O2可以透过聚四氟乙烯薄膜,根据电池电动势变化可以测得O2的含量。在气体传感器工作过程中,下列有关说法正确的是
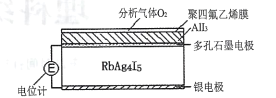
A.银电极被消耗,RbAg4I5的量增多
B.电位计读数越大,O2含量越高
C.负极反应为Ag+I--e-= AgI
D.部分A1I3同体变为Al和AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() 和
和![]() 都有手性碳原子
都有手性碳原子
B. NH4+与H3O+中心原子的价层电子对数相同
C. BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同
D. SO2和O3是等电子体,但两者具有不同的化学性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com