
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为890.3 kJ/ mol,则甲烷燃烧的热化学方程式可表示为:
mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol ,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol
C.NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:填空题
(1)写出下列反应的离子反应方程式
①用小苏打片治疗胃酸过多的离子方程式为______________________
②如果病人同时患有胃溃疡,此时最好服用胃舒平{主要成分是Al(OH)3},反应的离子方程式为__________________________
③硫酸氢钠溶液中滴加过量的氢氧化钡_________________________
(2) 写出符合下列离子反应的化学方程式
①Ca2++CO32-=CaCO3↓________________________
② Cu2++Fe=Cu+Fe2+______________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考三化学卷(解析版) 题型:选择题
等质量的两块钠,第一块在足量氧气中加热.第二块在足量氧气中(常温)充分反应,下列说法正确的是( )
A.第一块钠失去的电子多 B.两块钠失去的电子一样
C.第二块钠的反应产物质量大 D.两块钠的反应产物质量一样大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高二上联考二化学试卷(解析版) 题型:填空题
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高二上联考二化学试卷(解析版) 题型:选择题
向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )
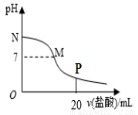
A.M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高二上联考二化学试卷(解析版) 题型:选择题
运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有 HF,因此 NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水 在低温高压下形成的水合物晶体,因此可存在于海底
在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率, 则用浓硫酸与铁反应能增大生成 H2的速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一上学期12月月考化学试卷(解析版) 题型:选择题
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,错误的是( )
A.该反应中氧化剂是Cl2
B.根据该反应可判断还原性:S2O32-<Cl-
C.上述反应中,每生成l mol SO42-,转移4 mol电子
D.Na2O2与氯气的漂白原理相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:实验题
已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-═2H2O+I2,且生成I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成I2完全消耗.由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝.因此,根据试剂X量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-═2H2O+I2反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 双氧水 | 0.1mol·L-1 稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。
实验2中m= ,n= 。
(2)一定温度下,H2O2+2H++2I-═2H2O+I2,反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为反应速率常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=__________min;
②根据上表数据可知,a、b的值依次为 和 。
(3)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津静海一中高一12月学业调研化学卷(解析版) 题型:选择题
能跟Fe3+作用,且可证明Fe3+具有氧化性的是
① SCN— ② Fe ③ Fe2+ ④ Cu ⑤ OH—
A.②④ B.①③ C.②⑤ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com