
【题目】如图所示,A、B、C是实验室常用的三种气体发生装置,现有药品:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。欲利用这些药品制取NH3、Cl2、H2、CO2四种气体,试回答下列问题。
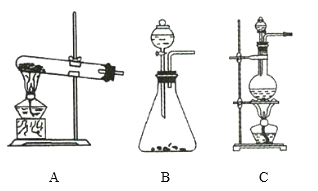
(1)①写出制取氨气的化学方程式: _____________________ ,氨气可用 _____________________ 进行干燥。
②制取![]() 的化学方程式为 _____________________ ,制取
的化学方程式为 _____________________ ,制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
(2)①制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
②生成的氯气先通过盛有 _____________________ 的洗气瓶,除去 _____________________ 气体。
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.C(s)+![]() O2(g)===CO(g) ΔH=-110.5kJ·mol-1
O2(g)===CO(g) ΔH=-110.5kJ·mol-1
B.CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
C.H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11036kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐![]() 仅含四种元素
仅含四种元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验: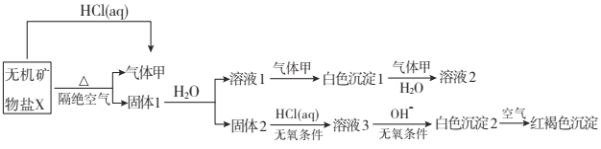
另取![]() 在惰性气流中加热至完全分解,得到
在惰性气流中加热至完全分解,得到![]() 固体1。请回答如下问题:
固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图__________,写出气体甲的电子式 __________。
(2)![]() 的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________![]() 用化学反应方程式表示
用化学反应方程式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物有广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:

(1)加入H2O2氧化时,发生反应的离子方程式为___。
(2)在实验室煅烧滤渣2制得的金属氧化物为___(填化学式),需要的仪器除酒精灯、三脚架以外,还需要___(填序号)。
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为___。
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=___molL-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11)。
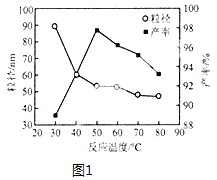
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO。如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为___。
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图2如。该电池工作时,石墨电极发生的电极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。
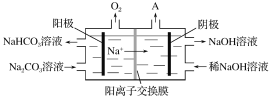
②“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为___________,阴极产生的物质A的化学式为________。
(2)与常规方法不同,有研究者用HCl—CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生,回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO·),请写出BDD电极上的电极反应________,进一步反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式__________。
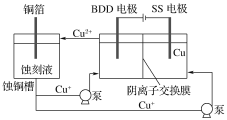
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
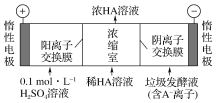
①阳极的电极反应式为____________。
②简述浓缩室中得到浓乳酸的原理:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com