
下列反应中,SO2表现出氧化性的是( )
A.SO2+Br2+H2O══2HBr+H2SO4
B.SO2+2NaOH══Na2SO3+H2O
C.SO2+2H2S══2H2O+3S↓
D.SO2通入品红溶液,溶液褪色
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
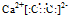
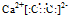
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | SO2(mol) | O2(mol) | 氦气(mol) | 达平衡时实际热效应(kJ?mol-1) |
| 甲 | 2 | 1 | 0 | △Hl |
| 乙 | 1 | 0.5 | 0 | △H2 |
| 丙 | 1 | 0.5 | 1 | △H3 |
| A、△Hl=-197 kJ?mol-1 |
| B、△H2=△H3 |
| C、△Hl=2△H2 |
| D、△Hl>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500 ℃时,将10 mol SO2和5.0 mol O2置于体积为2L的恒容密闭容器中,反应中数据如下表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
①反应前4分钟的平均速率v(O2)= 。
②500℃时该反应的平衡常数K = 。
(3)恒温恒压,通入3mol SO2 和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2、3.5 mol O2、1mol SO3(g),下列说法正确的是 。
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com