
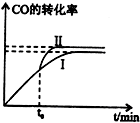
 二甲醚是一种重要的清洁燃料,有多种合成方法.
二甲醚是一种重要的清洁燃料,有多种合成方法.| 0.6×0.6 |
| 0.32 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、0.5mol |
| B、0.8mol |
| C、1.1mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
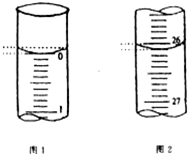 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-查看答案和解析>>
科目:高中化学 来源: 题型:
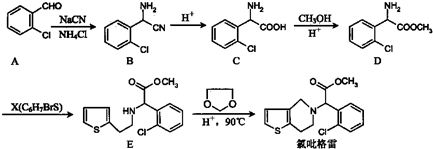
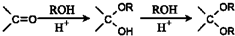
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X-、Y-、Z-、W-中Z-的还原性最强 |
| B、X2、Y2、Z2、W2中Z2的氧化性最弱 |
| C、2Z-+Y2═2Y-+Z2不能向右进行 |
| D、还原性X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀氨水中滴加AgNO3溶液来配制银氨溶液,银氨溶液久置容易爆炸,要随配随用 |
| B、用标准NaOH溶液测定食醋中醋酸含量时应该使用酚酞作为指示剂 |
| C、将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯水具有强氧化性 |
| D、重结晶法提纯KNO3产品除去少量NaCl时,应在较高温度下溶解产品配成浓溶液后冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com