
| A. | X能形成化学式为H2XO4的酸 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
分析 根据核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,X为N元素,符合题意;n=3时,最外层电子数为7,质子数为17,X为Cl元素,符合题意,以此来解答.
解答 解:根据核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,X为N元素,符合题意;n=3时,最外层电子数为7,质子数为17,X为Cl元素,符合题意,
A.由于元素X可能为氮元素或氯元素,因此不可能形成化学式为H2XO4的酸,故A错误;
B.N元素能与金属Mg元素形成化合物Mg3N2,Cl元素能与金属Na元素形成化合物NaCl,故B正确;
C.最外层电子数为2n+1,原子核内质子数是2n2-1,根据奇偶性可知,X原子的最外层电子数和核电荷数肯定为奇数,故C正确;
D.元素X可能为氮元素或氯元素,可形成KNO3或KClO3,故D正确.
故选A.
点评 本题考查原子结构中电子层数、最外层电子数、质子数的关系,根据原子序数判断剩余短周期,再讨论解答,难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.28mol | B. | 0.3lmol | C. | (n+0.2)mol | D. | (n+0.1)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
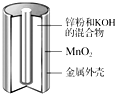 碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.
碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com