
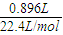 =0.04mol,
=0.04mol,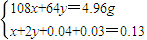
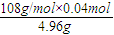 ×100%=87.1%,
×100%=87.1%,

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:福建省四地六校联考2010-2011学年高一第三次月考化学试题 题型:038
为了测定某铜银合金的组成,将17.2 g合金溶于50 ml的11.0 mol/L的浓硝酸中,待合金完全溶解后,只生成NO2和NO气体,共4.4.8 L(标准状况下),并测得此时溶液中硝酸的物质的量浓度为1.0 mol·L-1;假设反应后溶液的体积仍为50 ml.已知:
Ag+HNO3(
浓)3Ag+4HNO3(
稀)(1)被还原的硝酸的物质的量
(2)合金中银的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
将30.0 g某铜银合金溶于80 mL13.5 mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液的pH=0。假设反应所得气体只可能是NO2、NO或它们的混合物,反应后溶液的体积仍为80 mL。试计算:
(1)合金中银的质量分数。
(2)所得气体的组成(若为混合物,需算出各组成成分的体积)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com