
| A. | 新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2 | |
| C. | 向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应 | |
| D. | 新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+ |
分析 根据氯气溶于水,部分氯气与水反应发生反应:Cl2+H2O?HCl+HClO,HClO?H++ClO-,HCl=H++Cl-,所以氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,利用离子、分子的性质来分析.
解答 解:A.氯气是黄绿色气体,且有刺激性气味,如果氯水溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在,故A正确;
B.盐酸具有酸性,次氯酸具有漂白性,所以新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有盐酸和次氯酸,故B错误;
C.氯气能氧化碘离子生成单质碘,碘遇淀粉变蓝,向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2,Cl2可以与盐发生置换反应,故C正确;
D.新制氯水中存在盐酸,新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+,故D正确;
故选B.
点评 本题考查氯水的成分及氯水中各微粒的性质,明确离子、分子的性质是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | W克该原子的物质的量一定是$\frac{W}{a{N}_{A}}$ mol | |
| C. | W克该原子中含有$\frac{W}{b}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
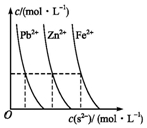 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低的温度 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 对于CO(g)+NO2(g)?CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液中所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
已知可逆反应:M(g)+N(g) P(g)+Q(g),△H>0请回答下列问题:
P(g)+Q(g),△H>0请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_____________;
(2)若反应在相同条件下进行达到平衡后,再向容器中充入M气体,再次达到平衡时该反应的平衡常数K_________(填“增大”“减小”或“不变”下同)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1, c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com