
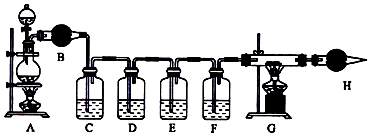
分析 (1)生铁中的碳与浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;浓硫酸与铁反应生成硫酸铁和二氧化硫气体,反应的方程式为:6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O↑+3SO2↑和浓硫酸变成稀硫酸后,稀硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑,由此分析解答;
(2)要检验二氧化碳、二氧化硫和水,需要先用无水硫酸铜粉末检验水;E中盛放品红溶液用于检验二氧化硫是否除尽,由此分析解答;
(3)G装置是验证氢气,所以G中可以是黑色的氧化铜,如果黑色粉末变红色,证明产物中有氢气;
(4)F装置验证二氧化碳气体的存在,所以F装置中是氢氧化钡,如果氢氧化钡变浑浊,说明有二氧化碳气体存在;
(5)F装置出来的气体中含有大量的水份,所以氢气还原氧化铜,得到水蒸气,对实验产生干扰.
解答 解:(1)生铁中的碳与浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;浓硫酸与铁反应生成硫酸铁和二氧化硫气体,反应的方程式为:6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O↑+3SO2↑和浓硫酸变成稀硫酸后,稀硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O↑+3SO2↑;Fe+H2SO4=FeSO4+H2↑;
(2)要检验二氧化碳、二氧化硫和水,需要先用无水硫酸铜粉末检验水;E中盛放品红溶液用于检验二氧化硫是否除尽,避免其对二氧化碳的检验形成干扰,故答案为:检验产物水;检验二氧化硫是否除尽,避免其对二氧化碳的检验形成干扰;
(3)G装置是验证氢气,所以G中可以是黑色的氧化铜,如果黑色粉末变红色,证明产物中有氢气,故答案为:氧化铜;黑色粉末变红色;
(4)F装置验证二氧化碳气体的存在,所以F装置中是氢氧化钡,如果氢氧化钡变浑浊,说明有二氧化碳气体存在,离子反应方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O,故答案为:氢氧化钡;Ba2++2OH-+CO2=BaCO3↓+H2O;
(5)F装置出来的气体中含有大量的水份,所以氢气还原氧化铜,得到水蒸气,对实验产生干扰,所以应在装置F与装置G之间增加一个装有浓硫酸的洗气瓶,故答案为:应在装置F与装置G之间增加一个装有浓硫酸的洗气瓶.
点评 本题考查了浓硫酸的性质、常见气体的检验,题目难度中等,明确常见气体的性质及检验的先后顺序为解答关键,注意掌握浓硫酸具有的性质及反应原理,明确化学实验基本操作方法及其应用,试题培养了学生达到分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
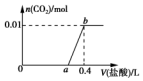 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
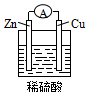
| A. | 铜片是负极 | B. | 氢离子在铜片表面被还原 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片质量逐渐减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com