
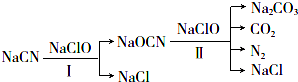
分析 (1))NaCN易与酸发生反应生成HCN,而HCN有剧毒,故应该使溶液的pH呈碱性;NaCN与NaClO反应生成NaOCN和NaCl,根据反应方程式计算;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,结合氧化还原反应中化合价升降相等配平;
(3)参加反应的NaCN为$\frac{100(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,利用电子守恒计算.
解答 解:(1)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性;NaCN与NaClO反应生成NaOCN和NaCl,其反应方程式为:NaCN+NaClO=NaOCN+NaCl,所以欲使1molNaCN变为NaOCN,则需要氧化剂NaClO为1mol;
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;1;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,氮元素被氧化.
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;氮;
(3)参加反应的NaCN是:$\frac{100(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:$\frac{20mol×5}{2}$×74.5g/mol×4=1490g,
故答案为:1490.
点评 本题考查了氧化还原反应方程式书写、计算等,题目难度中等,明确氧化还原反应的实质及配平原则为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸甲酯 | B. | 甲酸乙酯 | C. | 乙酸乙酯 | D. | 乙酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
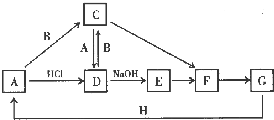 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com