
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
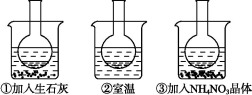
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为 。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、 、 (填“左”“右”或“不移动”)。
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应产物中SO2和NH3的物质的量之比为
A.1:4 B. 3:4 C. 4:1 D. 4:3
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:填空题
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)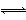 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)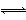 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:选择题
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
A.0.1 sB.2.5 sC.5 sD.10 s
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HC)>c(C)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(N)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:选择题
已知:2Zn(s)+O2(g) 2ZnO(s) ΔH=-701.0 kJ·mol-1
2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s) ΔH=-181.6 kJ·mol-1
2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s) ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3.1电解原理试卷(解析版) 题型:填空题
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
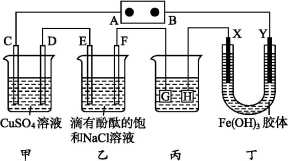
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“铜件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
A.BaSO4的溶度积常数比BaCO3的小
B.S没有毒性,C有毒性
C.BaSO4的密度大
D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com