
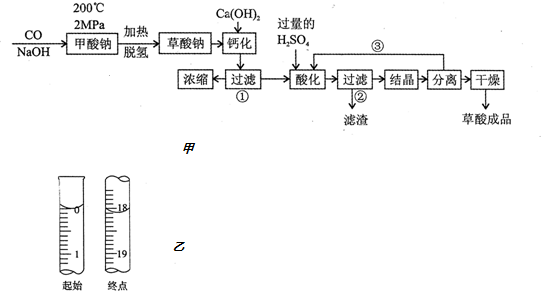
分析 (1)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物;
(2)循环利用的物质能降低成本,减少污染;
(3)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,所以过滤操作①的滤液是氢氧化钠溶液,滤渣是CaC2O4,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物,该操作过程中,稀硫酸过量,所以过滤操作②的滤液是H2C2O4溶液、H2SO4溶液,
故答案为:CaC2O4 ;H2C2O4溶液、H2SO4溶液;
(2)硫酸和氢氧化钠都具有腐蚀性,能污染环境,分别循环利用硫酸和氢氧化钠溶液,能降低成本,
故答案为:分别循环利用氢氧化钠和硫酸能降低成本,减小污染;NaOH;
(3)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质,存在于溶液中,所以含有的杂质主要是Na2SO4,
故答案为:Na2SO4;
(4)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
②根据图中的数据,注意滴定管精确到0.01mL,读数为18.10mL,故消耗KMnO4溶液体积为18.10mL,设草酸的物质的量为xmol,则:
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1×0.018L
所以,5mol:2mol=x:0.0500mol•L-1×0.015L
解得x=0.00225mol,
故其纯度=$\frac{0.00225mol×126g/mol}{0.25g}$×100%=81.45%,
故答案为:81.45%;
③根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,当加入的标准液偏多,理论上草酸的浓度偏大,但实际上其纯度偏小,
a.未干燥锥形瓶,对溶质的物质的量无影响,不影响测定;
b.滴定起始时滴定管尖嘴中产生气泡,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,可知V(标准)偏大,c(待测)偏大;
c.滴定终点时仰视读数,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,将标准液读数度大,V(标准)偏大,c(待测)偏大;
d.滴定管未用标准溶液润洗,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,表面上有水,加入的标准液偏多,可知V(标准)偏大,c(待测)偏大;
故选bcd.
点评 本题考查了化学与技术,明确操作时发生的化学反应、常见的操作名称,难点是计算草酸结晶水合物的纯度,根据方程式进行分析解答,难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.05mol | C. | 0.15mol | D. | 0.11mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有三种含氧官能团 | |
| B. | 可发生取代、加成及氧化反应 | |
| C. | 在水溶液中羟基和羧基均能电离出氢离子 | |
| D. | 与足量的钠反应在标况下能产生44.8L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
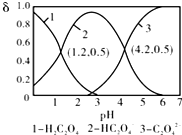
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com