
| A. | 1:2 | B. | 2:3 | C. | 4:5 | D. | 5:1 |
分析 常温下,a摩尔H2S和b摩尔SO2,发生2H2S+SO2═3S+2H2O的反应,并结合相同条件下,物质的量之比等于压强之比计算.
解答 解:(1)SO2过量,H2S反应完
2H2S+SO2═3S+2H2O
2 1
a $\frac{a}{2}$
n(剩余气体)=b-$\frac{a}{2}$
∵反应后溶器内压强为反应前的一半
∴反应后溶器内气体物质的量为反应前的一半
即$\frac{b-\frac{a}{2}}{a+b}$=$\frac{1}{2}$则$\frac{a}{b}$=$\frac{1}{2}$
(2)H2S过量,SO2反应完
2H2S+SO2═3S+2H2O
2 1
2b b
n(剩余气体)=a-2b
∵反应后溶器内压强为反应前的一半
∴反应后溶器内气体物质的量为反应前的一半
即$\frac{a-2b}{a+b}$=$\frac{1}{2}$则$\frac{a}{b}$=$\frac{5}{1}$
故选AD.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及物质的状态、物质的量与压强的关系为解答的关键,注意常温下水为液体,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
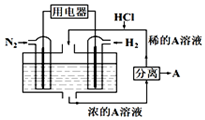 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图,NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子 | |
| B. | 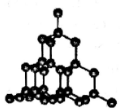 如图,金刚石中存在的化学键只有共价键,不能导电 | |
| C. | 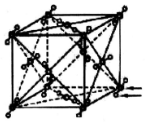 如图,干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华 | |
| D. | 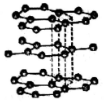 如图,石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
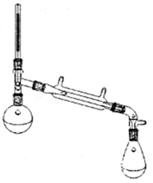 环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯: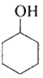 $→_{△}^{H_{2}SO_{4}}$
$→_{△}^{H_{2}SO_{4}}$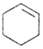 +H2O
+H2O| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com