
分析 用ClO2 处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2,该反应中Cl元素化合价由+4价变为-1价、N元素化合价由-3价变为0价,C元素化合价由+2价变为+4价,结合化合价的变化解答该题.
解答 解:氰化钠中钠元素为+1价,氮元素为-3价,依据化合价代数和为0,可知碳元素为+2价;
用ClO2 处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2,该反应中Cl元素化合价由+4价变为-1价、N元素化合价由-3价变为0价,C元素化合价由+2价变为+4价,反应的方程式为2ClO2+2NaCN=2NaCl+N2+2CO2,n(NaCN)=4×10-5mol•L-1×1000L=0.04mol,根据方程式知,消耗二氧化氯物质的量为0.04mol,其质量=0.04mol×67.5g/mol=2.7g,
故答案为:2.7.
点评 本题考查了氧化还原反应方程式的书写及有关计算,为高频考点,侧重考查学生的分析能力和计算能力,明确氧化还原反应得失电子守恒规律是解题关键,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
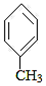 +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$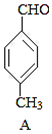 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$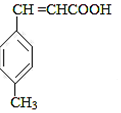 $→_{浓硫酸,△}^{CH_{3}OH}$E
$→_{浓硫酸,△}^{CH_{3}OH}$E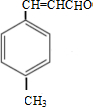 ,生成E的反应类型为酯化反应或取代反应
,生成E的反应类型为酯化反应或取代反应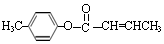 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为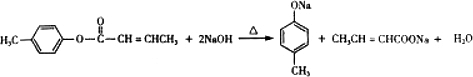 .
.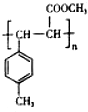 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 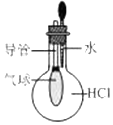 用装置验证 HCl 气体易溶于水 | |
| B. | 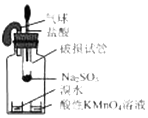 用装置验证 SO2具有漂白性 | |
| C. | 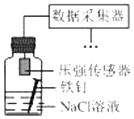 用装置采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 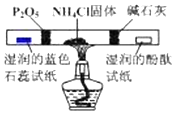 用装置检验 NH4Cl 分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大最共存 | |
| B. | 在含有0.1mol/L Fe3+的溶液中:SCN-、Cl-、K+不能大最共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-变化最小 | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
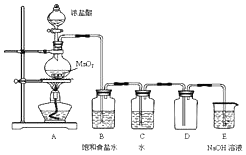 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
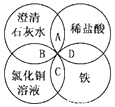 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com