
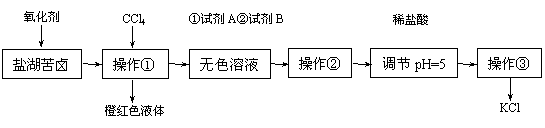
 (12分)某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
(12分)某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
请根据上述流程,回答以下问题:
⑴要从橙红色液体中分离出溴,可采取的操作是 。
⑵试剂A中有两种溶质,它们是 ,试剂B成分是 。(填化学式)
⑶检验SO42-已除尽的方法是_________________________________________。
⑷用盐酸调节溶液的pH至pH=5的目的是 。
⑸控制溶液pH=12可确保Mg2+除尽,此时溶液中Mg2+物质的量浓度为 。
(已知Mg(OH)2的Ksp=1.6×10-11)
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:阅读理解

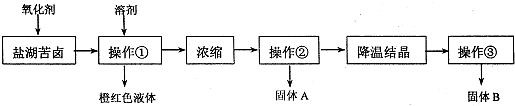
 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
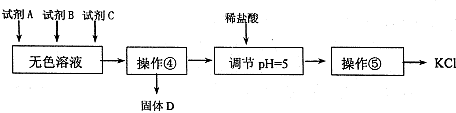
科目:高中化学 来源: 题型:阅读理解


| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
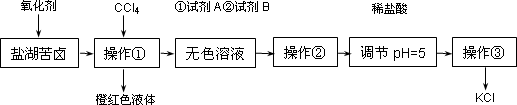
请根据上述流程,回答以下问题:
(1)要从橙红色液体中分离出溴,可采取的操作是________.
(2)试剂A中有两种溶质,它们是________,试剂B成分是________.(填化学式)
(3)检验SO42-已除尽的方法是________.
(4)用盐酸调节溶液的pH至pH=5的目的是________.
(5)控制溶液pH=12可确保Mg2+除尽,此时溶液中Mg2+物质的量浓度为________.(已知Mg(OH)2的Ksp=1.6×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com