
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
分析 pH均为3的醋酸溶液和稀硫酸中,氢离子浓度一样,对水的抑制程度一样,但是醋酸是弱酸,加水会促进电离,所以加水稀释等体积倍数后,醋酸的酸性会强于硫酸,和金属锌反应的速率和氢离子浓度大小有关,和氢氧化钠反应,消耗同浓度氢氧化钠溶液的体积和酸的浓度大小有关系.
解答 解:pH均为3的醋酸溶液和稀硫酸中,氢离子浓度一样,醋酸是弱酸,加水会促进电离.
①物质的量浓度:醋酸的大于硫酸,故错误;
②pH均为3,氢离子浓度一样,故正确;
③pH均为3,氢离子浓度一样,与足量锌反应时的初始速率相等,故正确;
④电离程度不同,强酸完全电离,弱酸部分电离,故错误;
⑤pH均为3的醋酸溶液和稀硫酸中,醋酸浓度大,中和等体积的两种酸,所需同浓度氢氧化钠溶液的体积:醋酸的多,故错误;
⑥醋酸是弱酸,加水会促进电离,所以加水稀释等体积倍数后,醋酸的酸性会强于硫酸,即稀释相同倍数后的pH不同,故错误.
故选B.
点评 本题考查学生弱电解质的电离、影响反应速率的因素以及pH的有关计算等知识,注意知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
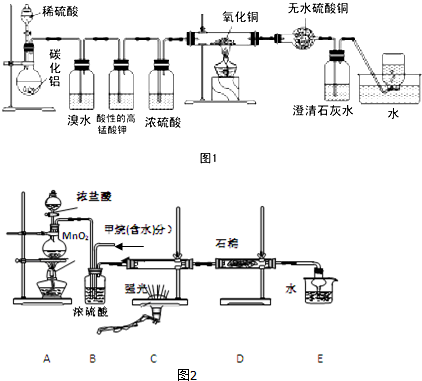
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ③④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
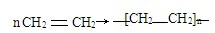 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com