
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |
 ,下列叙述正确的有
,下列叙述正确的有 的熔点(填>、=或<),其原因是
的熔点(填>、=或<),其原因是查看答案和解析>>
科目:高中化学 来源: 题型:
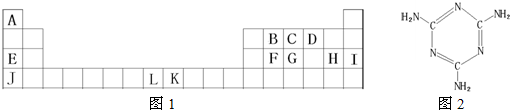
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省长春市十一中高一下学期期初考试化学试卷(带解析) 题型:填空题
有下列物质:① MgF2②Na2O2③NaOH ④HCl ⑤H2O2⑥NH4Cl ⑦Cl2
(1). 只由极性键构成的物质是________;只由非极性键构成的物质是__ __;
只由非金属元素组成的离子化合物是____; 由离子键和非极性键构成的物质是_____________,由极性键和非极性键构成的物质是______________.(填序号)
(2).已知:Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3 kJ/mol
2Ag(s)+1/2 O2(g)="=" Ag2O(s);ΔH=-31.0 kJ/mol
则Zn(s)+ Ag2O(s)="=" ZnO(s)+ 2Ag(s)的ΔH=
(3).氧化还原反应中除了原子守恒(质量守恒)外,氧化剂得电子总数和还原剂失电子总数相等,在一定条件下, 和I-发生反应的离子方程式为:
和I-发生反应的离子方程式为: +6I-+6H+=R-+3I2+3H2O(R为主族元素)则:
+6I-+6H+=R-+3I2+3H2O(R为主族元素)则:
① 中R的化合价为 价,n值为 。
中R的化合价为 价,n值为 。
②R元素最外层电子数为 个,在周期表的 族。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷解析版) 题型:填空题
“物质结构与性质”模块(10分)
请回答下列问题:
(1)N、AI、Si、Zn四种元素中,有一种元素的电离能数据如下:

(2)则该元素是__①___(填写元素符号)。Zn原子的电子排布式是__②__。Ce的最高价氯化物分子式是_ __③___。该元素可能的性质或应用有__④___。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物  ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个 键和1个
键和1个 键
键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 ⑥  的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com