

分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解于异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4;
(1)NaBH4中Na为+1价,B为+3价,可结合化合物中各元素正负化合价代数和为0,计算出氢元素的化合价,①反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平方程式;
(2)原料中的金属钠通常保存在煤油中,需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,为防止安全事故发生和防止NaBH4水解,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,从而排出空气和水蒸气;
(3)分离难溶性固体和溶液采用过滤方法;熔沸点相差较大的可以采用蒸馏方法;
(4)n(NaBH4)=$\frac{3.8g}{38g/mol}$=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,据此书写热化学方程式.
解答 解:NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
(1)NaBH4中根据化合物中各元素正负化合价代数和为0,并结合Na为+1价、B为+3价计算出H为-1价,第①步反应中根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,电子转移数目为4e-,
故答案为:-1价;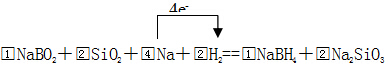 ;
;
(2)钠的密度大于煤油,为隔绝空气和水,原料中的金属钠通常保存在煤油中,实验室取用少量金属钠时,需要镊子夹取钠、用滤纸吸煤油,所以实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出,钠极易和空气中氧气、和水反应,故答案为:镊子;除去装置中的空气和水蒸气;
(3)分离难溶性固体和溶液采用过滤方法,②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,所以第②步分离采用的方法是过滤;熔沸点相差较大的可以采用蒸馏方法,异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,故答案为:过滤;蒸馏;
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),n(NaBH4)=$\frac{3.8g}{38g/mol}$=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,则热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、热化学反应方程式的书写、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).
如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备O2:用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| B. | 提纯含有少量HCl的Cl2:将含有少量HCl的Cl2通入饱和的NaHCO3溶液和浓硫酸中净化气体 | |
| C. | 检验溶液中是否含有CO32-:向溶液中加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量的CO32- | |
| D. | 探究测定铝箔中氧化铝含量:取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器体积不变,充入O2,平衡向右移动,O2的转化率一定增大 | |
| B. | 若容器体积不变,充入Ar,容器内压强增大,平衡向右移动 | |
| C. | 若容器体积不变,升高温度,平衡向左移动,平衡常数K减小 | |
| D. | 若容器压强不变,再充入1 mol SO2和0.5 mol O2,达到新平衡时c(SO2)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com