
【题目】反应CO(g)+2H2(g)CH3OH(g).反应的平衡常数如表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×102 | 2.4×104 | 1×105 |
A. 该反应的△H>0
B. 加压缩体积或增大CO浓度都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该反应温度在0-100℃之间
【答案】D
【解析】
A.由表格中数据,温度越高,K越小;
B.加压、增大H2浓度均促进CO的转化,但增大CO浓度不能提高CO的转化率;
C.该反应为放热反应,升高温度平衡逆向移动;
D.t℃时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50%,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.1 0.2 0
转化 0.05 0.1 0.05
平衡 0.05 0.1 0.05
K=0.05/0.05×(0.1)2,由此分析。
A.由表格中数据,温度越高,K越小,则升高温度平衡逆向移动,正反应为放热反应,△H<0,故A错误;
B.加压、增大H2浓度均促进CO的转化,但增大CO浓度不但不能提高CO的转化率,CO的转化率反而降低,故B错误;
C.该反应为放热反应,升高温度平衡逆向移动,降低原料气的转化率,故C错误;
D.t℃时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50%,则 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.1 0.2 0
转化 0.05 0.1 0.05
平衡 0.05 0.1 0.05
K=0.05/0.05×(0.1)2=100,故D正确;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别
A. 酚酞试液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝及其化合物的离子方程式正确的是
A. 向NaOH溶液中加入铝粉:Al + OH—+ H2O → AlO2— + H2↑
B. 向AlCl3溶液中通入过量氨气:Al3+ + 3OH— → Al(OH)3 ↓
C. 向Al(OH)3 中加入NaOH溶液 :Al(OH)3 + OH— → AlO2— + 2H2O
D. 明矾净水的原理:Al3+ + 3H2O ![]() Al(OH)3↓ + 3H+
Al(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:4 Na + 3CO2![]() 2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式_____________________,若3v正(Na)=4v逆(CO2),则_____(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6 g,该时间段内v(CO2)=______________,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”) 。
(3)反应中还有石墨生成,已知:C(石墨)![]() C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
(4)碳酸钠溶液中滴入盐酸的反应过程如右图所示,反应至A点时,未产生二氧化碳,请用离子方程式解释原因:_________________,继续滴加盐酸,反应至B点,B点溶液中溶质的化学式是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化

试回答:
(1)写出B的化学式___________________,D的化学式_________________________。
(2)写出由E转变成F的化学方程式______________________________________。
(3)写出F转化成G的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是

A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.21 NA
C. 原苛性钾溶液中KOH的物质的量无法确定
D. 生成物中Cl- 的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O 外, 含有 CCl4、 I2、 I-等)中回收碘, 其操作流程如下:
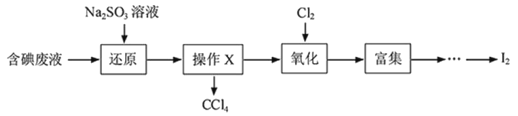
下列说法不正确的是:
A. 还原时,发生的主要反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B. 加入 Na2SO3 溶液的目的是使碘元素进入水层
C. 操作X 的名称为萃取, 应在分液漏斗中操作
D. 氧化时,应控制在较低温度(40℃左右), 可增大 Cl2 的溶解度并减少 I2 的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com