
| A. | 氯化铵 | B. | 硫酸 | C. | 食盐 | D. | 氧化钠 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为36 | |
| B. | 容器②中反应达到平衡时放出的热量为0.05QkJ 达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol•L-1 | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:2s22p1 Y:2s22p4 | B. | X:3s23p1 Y:3s23p5 | ||
| C. | X:3s23p2 Y:2s22p3 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
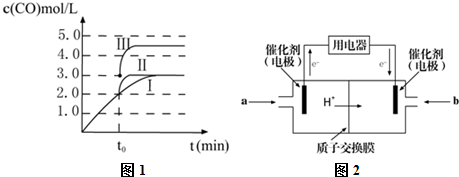
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
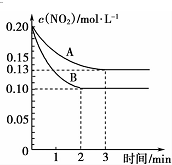
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com