
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
【答案】C
【解析】
A. 电镀池中,作阳极的是镀层金属,作阴极的是待镀金属;
B. 氯气与水的反应为可逆反应;
C. 由方程式可知该反应为熵增大的反应,根据复合判据确定ΔH的大小;
D. 向氨水中缓慢通入CO2,NH3H2O浓度减小,NH4+浓度增大,再结合电离常数进行分析判断。
A. 电镀池中,作阳极的是镀层金属,作阴极的是待镀金属,因此铜与电源的正极相连,铁与电源的负极相连,A项错误;
B. 氯气与水的反应为可逆反应,因此HClO、Cl-、ClO-粒子数之和小于2×6.02×1023,B项错误;
C. 由方程式可知该反应为熵增大的反应,根据复合判据可知,该反应ΔH>0,C项正确;
D. 向氨水中缓慢通入CO2,NH3H2O浓度减小,NH4+浓度增大,由于 是常数,因此
是常数,因此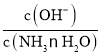 减小,D项错误;
减小,D项错误;
答案选C。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )
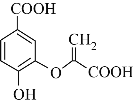
A. 可看成羧酸类、酯类等B. 分枝酸分子中含有3种官能团
C. 分子式为C10H10O 6D. 1mol分枝酸最多可与3molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲。红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。
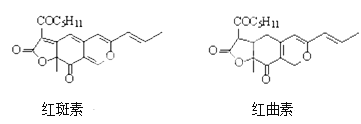
下列说法正确的是
A. 红斑素和红曲素都存在2个手性碳原子
B. 一定条件下红斑素和红曲素都能发生加聚和自身的缩聚反应
C. 红斑素中含有醚键、羰基、酯键这三种含氧官能团
D. 1 mol红曲素最多能与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
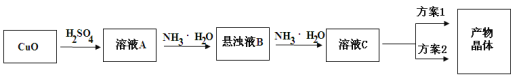
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ ![]() Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
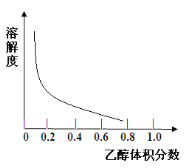
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____。
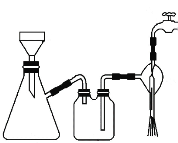
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____杂质,产生该杂质的原因是______。
(2)方案2的实验步骤为:a.向溶液C中加入适量____,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________。
③步骤d采用________干燥的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。如CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为 。下列说法不正确的是
。下列说法不正确的是
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于烃,则Y的结构简式可能为![]()
C. X能使酸性的高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() ,某无色溶液Y中可能含有以下几种离子:Cl-、SO
,某无色溶液Y中可能含有以下几种离子:Cl-、SO![]() 、HCO
、HCO![]() 、HSO
、HSO![]() 、Fe3+、Ba2+、NH
、Fe3+、Ba2+、NH![]() 、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
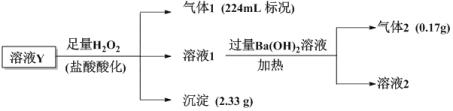
下列说法不正确的是
A.溶液1中一定不存在Fe3+、SO![]()
B.气体1为CO2气体
C.溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D.溶液Y中可能存在Na+,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________;氮元素的第一电离能呈现异常的原因是____。
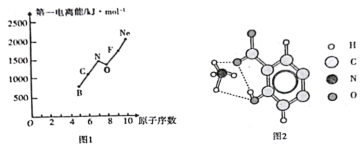
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________,不同之处为_________。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________、____________。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com