
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO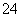 的物质的量浓度为6 mol·L-1,则此溶液最多能溶解的铁粉的质量为( )
的物质的量浓度为6 mol·L-1,则此溶液最多能溶解的铁粉的质量为( )
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
科目:高中化学 来源: 题型:
可逆反应A(g)+B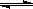 C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到
C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到
达平衡时,下列叙述不正确的是
A.若保持恒容,充入C气体后混合气体颜色加深,则说明B是有颜色的气体
B.若升高温度,发现C的物质的量减少,则说明正反应为放热反应
C.若压缩容器,平衡不移动,则说明B和D一定都是气体
D.保持恒容,到达平衡后继续充入A会使B的转化率增大,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器。左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体。同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如下图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)
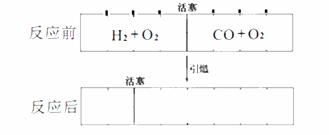
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2S溶液中下列关系不正确的是 ( )
A.c(Na+) =2c( HS-) +2c(S2-) +2c(H2S) B. c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C.c(Na+) > c(S2-) >c(OH-)>c(HS-) D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂废水中含游离态氯,通过下列实验测定其浓度。①取水样10.0ml于锥形瓶中,加入10.0ml的K I溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
⑴步骤①加入的指示剂是 。
⑵步骤②应使用 式滴定管。
⑶判断达到滴定终点的实验现象是 ;
⑷氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A、酸式滴定管未用标准盐酸溶液润洗 B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定时将标准液溅出锥形瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH 溶液中,由水电离的OH-离子数目为0.1NA
溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3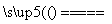 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,M(OH)2(S)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
A. 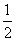 lg(
lg(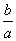 ) B.
) B. 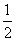 lg(
lg(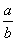 )
)
C.14+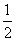 lg(
lg(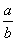 ) D.14+
) D.14+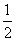 lg(
lg(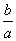 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2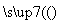 2NH3。
2NH3。
___________________________________ _____________________________________。
_____________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH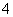 +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3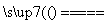 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:
N2H4+O2===N2+2H2O ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO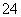 ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===[Al(OH)4]-。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3 Na++H++CO
Na++H++CO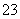 。
。
________________________________________________________________________。
(15)HCO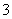 的水解方程式:HCO
的水解方程式:HCO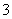 +H2O
+H2O H3O++CO
H3O++CO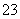 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO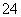 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH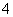 +H2O
+H2O NH4OH+H+。
NH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4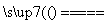 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
__________________________________________________________ ______________。
______________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2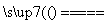 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
_______________________________________________________ _________________。
_________________。
(21)实验室利用H2O2分解制O2:2H2O2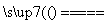 2H2O+O2↑。
2H2O+O2↑。
____ ____________________________________________________________________。
____________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
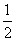 H2(g)+
H2(g)+ O2(g)
O2(g)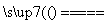
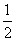 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
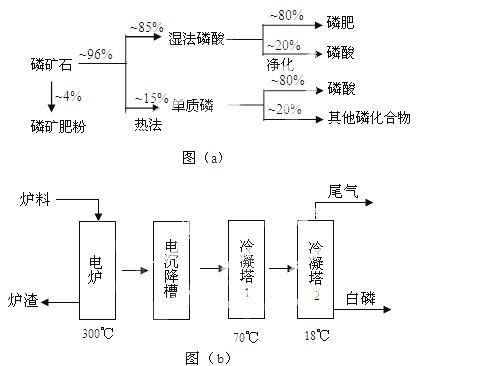
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:  。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品
。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品 磷酸 吨。
磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾 气先通入纯碱溶液,
气先通入纯碱溶液, 可除去
可除去 
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:  。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com