解:(1)①过氧化钠能和水反应生成氢氧化钠和氧气,所以氢氧化钠溶液含有大量的氢氧根离子,氨水能电离出氢氧根离子,所以过氧化钠与水反应生成的氢氧根离子使溶液中的氢氧根离子的浓度增大,抑制氨水的电离,有利于氨气的逸出,
故答案为:Na
2O
2与水反应生成OH
-,c(OH
-)增大,抑制NH
3?H
2O的电离,有利于NH
3的逸出;
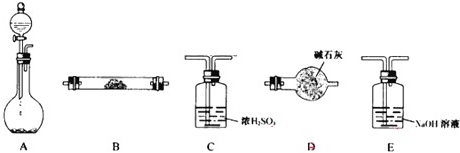
②用产生的气体做氨的催化氧化实验,产生的氨气中含有水蒸气,所以需要干燥装置,则,应选择装置D;氨气和氧气的反应需要反应装置,需要装置B;反应后的气体不能直接排空,需要尾气处理装置,以含有氮的氧化物,则用碱液来处理尾气,则选择装置E,所以装置连接顺序为D→B→E,
故答案为:D→B→E;
(2)当制备H
2、验证H
2还原性并检验H
2的氧化产物,需要的装置有制备H
2装置、验证H
2还原性装置、检验H
2的氧化产物装置和防止干扰装置,用氧化铜验证氢气的还原性,用无水硫酸铜验证氢气的氧化产物,用干燥管防止空气成分的干扰.
①氢气和氧化铜反应生成铜和水,所以氢气和氧化铜的反应方程式为H
2+CuO

H
2O+Cu;水能使无水硫酸铜变蓝色,所以可用无水硫酸铜检验H
2的氧化产物;空气有水蒸气,水蒸气的存在干扰H
2氧化产物的检验,所以D装置的作用是防止空气中的水进入装置,干扰H
2氧化产物的检验,
故答案为:H
2+CuO

H
2O+Cu;无水CuSO
4;防止空气中的水进入装置,干扰H
2氧化产物的检验;
②a、温度越高,反应速率越大,所以将烧瓶放入热水中能加快反应速率,故正确;
b、浓硫酸和锌反应不生成氢气,所以将稀H
2SO
4改为浓H
2SO
4不能加快生成氢气的反应速率,故错误;
c、在稀H
2SO
4溶液中滴入少量CuSO
4,锌能置换出铜,锌、铜和稀硫酸组成原电池,所以能加快反应速率,故正确;
d、在稀H
2SO
4中加入少量固体NaCl,加少量固体氯化钠,硫酸浓度不变,反应速率不变,故错误;
故选a、c;
③第一个B装置质量的变化是Yg,减少的质量为氧元素的质量.
H
2+CuO

H
2O+Cu 质量减少
2g 16g
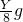
Yg
Zn+H
2SO
4=ZnSO
4+H
2↑
65g 2g
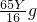
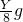
则锌片纯度为=
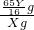
=

,
故答案为:

.
分析:(1)①根据浓氨水和过氧化钠的性质分析,过氧化钠能和水反应生成氢氧化钠和氧气,且该反应是放热反应;浓氨水有挥发性,温度越高挥发性越强,且氨水呈碱性,据此分析;
②用产生的气体做氨的催化氧化实验,需要的装置有干燥装置、反应装置、尾气处理装置;
(2)①当制备H
2、验证H
2还原性并检验H
2的氧化产物,需要的装置有制备H
2装置、验证H
2还原性装置、检验H
2的氧化产物装置和防止干扰装置,用氧化铜验证氢气的还原性,用无水硫酸铜验证氢气的氧化产物,用干燥管防止空气成分的干扰;
②根据影响化学反应速率的因素分析,影响因素有浓度、温度、催化剂等;先根据B装置质量减少的量计算需要的氢气的量,根据氢气的质量计算需要锌的质量,再根据质量分数公式计算即可.
点评:本题考查了常见气体的制备原理及装置选择,难度较大,明确选择装置的依据是解本题的关键.

 H2O+Cu;水能使无水硫酸铜变蓝色,所以可用无水硫酸铜检验H2的氧化产物;空气有水蒸气,水蒸气的存在干扰H2氧化产物的检验,所以D装置的作用是防止空气中的水进入装置,干扰H2氧化产物的检验,
H2O+Cu;水能使无水硫酸铜变蓝色,所以可用无水硫酸铜检验H2的氧化产物;空气有水蒸气,水蒸气的存在干扰H2氧化产物的检验,所以D装置的作用是防止空气中的水进入装置,干扰H2氧化产物的检验, H2O+Cu;无水CuSO4;防止空气中的水进入装置,干扰H2氧化产物的检验;
H2O+Cu;无水CuSO4;防止空气中的水进入装置,干扰H2氧化产物的检验; H2O+Cu 质量减少
H2O+Cu 质量减少 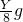 Yg
Yg 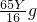
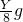
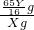 =
= ,
, .
.

 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途.
如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途. 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途.
如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途.