
| A. | “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 在细菌作用下铜矿石可以直接转换为单质铜.这个过程叫作生物炼铜 | |
| D. | 天津港爆炸事件中参与燃烧的一种危险品“甲苯二异氰酸酯(TDI)”,该危险品属于芳香烃 |
分析 A.温室效应的形成与二氧化碳有关;
B.依据液氨汽化时要吸收大量的热的性质判断其作用;
C.铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性的铜盐;
D.烃只含有C、H两种元素.
解答 解:A.“雾霆夭气”、“光化学烟雾”的形成都与氮氧化物有关,“温室效应”的形成与二氧化碳有关,与氮的氧化物无关,故A错误;
B.液氨汽化时要吸收大量的热,具有制冷作用,常用作制冷剂,故B正确;
C.生物炼铜原理是:在细菌的帮助下,氧气氧化硫化铜矿石为可溶解性硫酸铜,再进行简单的后续生产,故C错误;
D.芳香烃属于烃,只含有C、H两种元素,甲苯二异氰酸酯除了C、H外还含有O、N元素,不属于烃,故D错误;
故选:B.
点评 本题为综合题,考查了生活中常见的环境污染、物质的用途、生物炼铜原理、芳香烃的判断,解题时注意生物炼铜原理及烃的概念,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
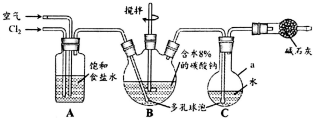 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
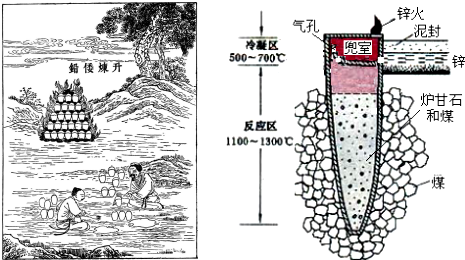
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
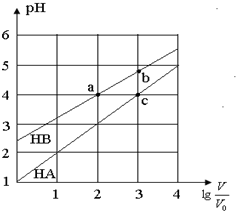 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
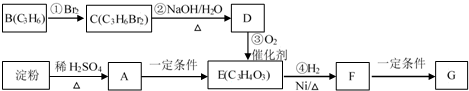
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤ | C. | ②③⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com