
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 1.8×10-5×0.1 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
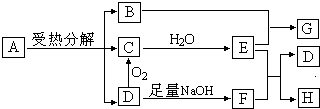
查看答案和解析>>
科目:高中化学 来源: 题型:
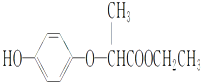
| A、1 mol HPE最多可以和2 mol NaOH反应 |
| B、HPE不能跟浓溴水反应 |
| C、HPE在1H核磁共振谱中有8种峰 |
| D、该物质不能发生在加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )
已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )| A、9种 | B、10种 |
| C、11种 | D、2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、表面迅速变暗是因为生成了氧化钠 |
| B、“出汗”是因为表面形成了NaOH溶液 |
| C、白色固体粉末是碳酸钠 |
| D、以上三个过程均发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、K+、SO32-、MnO4- |
| B、pH=7的溶液中:Na+、Al3+、Cl-、CO32- |
| C、pH>12的溶液中:Na+、K+、SO42-、AlO2- |
| D、pH=0的溶液中:Na+、I-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由反应可确定:氧化性HClO4>HClO |
| B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O=12H++10Cl-+2IO3- |
| C、若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示:26HClO3=15O2↑+8C12↑+10HClO4+8H2O |
| D、若化学计量数a=8,b=3,则该反应转移电子数为10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3的水解:HCO3-+H2O?H3O++CO32- | ||||
| B、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(1);△H=-57.3 kJ/mol | ||||
| C、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | ||||
D、以惰性电极电解KCl溶液:2Cl-+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com