
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;根据温度变化对化学平衡常数的影响分析该反应的焓变.
解答 解:反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)的平衡常数为:K=$\frac{c(C{O}_{2})}{c(CO)}$;
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,其△H<0,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;<.
点评 本题考查了化学平衡及其影响,题目难度不大,明确化学平衡常数的概念及表达式为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
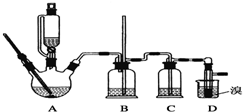
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
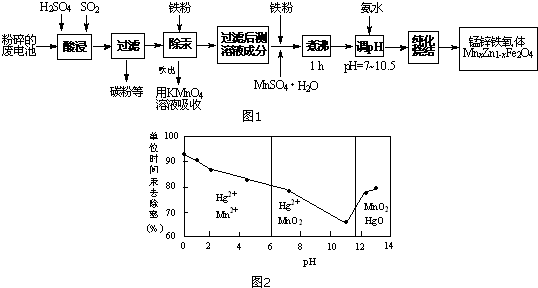
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
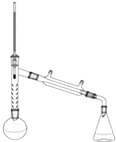 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: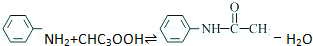
| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 易溶于乙醇、乙醚 |
| 酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和铁都是具有多种化合价金属,所同条件下与氧气反应时能得到不同的产物 | |
| B. | 将钠暴露在空气中,表面形成较为疏松的氧化膜,不能阻止其被继续氧化 | |
| C. | 钠元素的化学性质活泼,主要表现为具有还原性 | |
| D. | 金属铝的化学性质稳定,可以用来做日常用的铝制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com