
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析不正确的是( ) 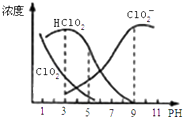
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
【答案】C
【解析】解:A、由图可以得出:碱性条件下ClO2﹣浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B、HClO2的电离平衡常数K= ![]() =10﹣3×10﹣3=10﹣6 , 故B正确;
=10﹣3×10﹣3=10﹣6 , 故B正确;
C、HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH,应该是4﹣5,故C错误;
D、依据电中性原则得出:c(H+)+c(Na+)=c(ClO2﹣)+c(OH﹣) ①,依据物料守恒得出:2c(Na+)=c(ClO2﹣)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣),故D正确,
故选C.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】恒温时,在密闭容器中进行可逆反应:N2+3H22NH3 , 达到平衡后,欲使正反应速率增大,可采取的措施是( )
A.缩小容器的容积
B.保持容器的容积不变,通入稀有气体
C.保持容器内压强不变,通入稀有气体
D.及时把生成的NH3分离出去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
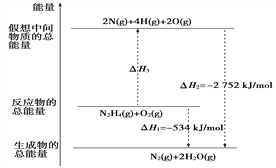
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝溶解于100mL3mol/LNaOH溶液中,然后向所得溶液中加入400mL,1mol/L的盐酸,最后可得沉淀的质量是( )
A.2.7g
B.5.2g
C.7.8g
D.10g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
(1)该反应该温度下,化学平衡常数的值为
(2)下列说法中能作为反应达到平衡状态标志的是(填字母).
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH﹣H键,同时断裂3molO﹣H键
(3)下列措施中能使 ![]() 减小的是
减小的是
A.再充入1molCO2和3molH2
B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大
D.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是( )
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(Lmin)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某温度下,水的离子积常数Kw=10﹣13 , 在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=1:10
B.已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为KaKh=Kw
C.常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度均降低
D.甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com