
【题目】体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是

A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
【答案】C
【解析】试题分析:A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH-)=c(XOH),XOH完全电离,为强电解质,A错误;B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒得c(X+):XOH小于X2CO3,B错误;C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=1014/1011.6mol/L=10-2.4mol/L,c(CO32-)=0.1mol/L,Kh1=c(HCO3)·c(OH)/c(CO32)=Kw/Ka2,则Ka2=Kw/Kh1=Kw·c(CO32)/[c(HCO3)·c(OH)]=1014×0.1/102.4×102.4=1.0×10-10.2,C正确;D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大,所以c(HCO3-)/c(CO32-)增大,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
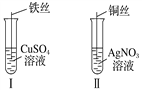
①Ⅰ中铁丝上观察到的现象是______________________;
②Ⅱ中发生反应的离子方程式为_______________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
①写出制备氢氧化铁胶体的化学方程式____________________.
②向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列反应的离子方程式:
(1)将鸡蛋壳在醋酸中溶解有气泡产生:______________________________________;
(2)CuSO4溶液与Ba(OH)2溶液混合:________________________________________。
(3)铁片插入硝酸银溶液中:_________________________________________________。
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有![]() 、Na+、
、Na+、![]() 、H+、
、H+、![]() 、
、![]() 、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是_________(填代号)。对该错误改正的方法是(要作较详细的说明)_________________________________________________________。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时焰色反应为黄色,下列判断正确的是( )
A. 该物质一定是钠的化合物 B. 该物质一定含钠元素
C. 该物质一定是金属钠 D. 该物质中一定含钠离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【哈师大附中2017届第四次模拟考试】常温下,在pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I-、Cl- 、CO32-中的几种,现取100mL该溶液进行如下实验。根据实验结果,下列判断正确的是

A.Fe2+、I-、Cl-三种离子一定存在
B.CO32-一定不存在,不能确定Na+和Cl-是否存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl-)至少为0.2molL1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
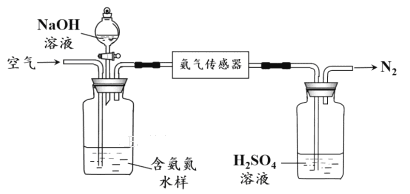
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,能大量共存的离子组是
A. Na+、K+、OH-、Cl- B. K+、Fe2+、Cl-、NO3-
C. Na+、ClO-、.SO42-、I- D. Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com