
分析 (1)根据电子守恒以及原子守恒知识来回答;
(2)根据物质和亚硝酸钠溶液之间的反应情况来判断;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,氧化还原反应中遵循电子守恒,以此来配平化学方程式;
(4)据化学方程式判断pH变化,NO2-转换为N2过程中N元素化合价降低,发生还原反应.
解答 解:(1)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,
则需氮元素的化合价降为+2价,
所以产物中含氮的物质为NO,故答案为:NO;
(2)据强酸制弱酸的原理,二氧化碳、二氧化硫和NaNO2不反应,不能生成HNO2,而稀硫酸和磷酸,就能和NaNO2反应,生成HNO2,
故答案为:bc;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,发生的反应是亚硝酸钠和金属铝之间的反应,即Al+NaNO2+NaOH→NH3•H2O+NaAlO2,铝元素化合价从0价升高到+3价
,氮元素的化合价从+3降到-3价,
根据电子守恒,所以亚硝酸钠的系数是1,铝元素前面系数是2,反应消耗了氢氧化钠,所以溶液的PH会减小,
故答案为:NaNO2+2Al;
(4)反应方程式为2Al+NaNO2+NaOH+2H2O=NH3•H2O+2NaAlO2,反应消耗了氢氧化钠,所以溶液的PH会减小,NO2-转换为N2过程中N元素化合价降低,发生还原反应,阴极发生还原反应,故答案为:下降;阴极.
点评 本题是一道综合知识的考查题,要求学生具有知识的梳理和迁移能力,难度大,综合性强.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯和丙三醇 | B. | 乙醇和丙烯 | C. | 甲烷和乙烯 | D. | 苯和丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置,而电解池是将电能转化为化学能的装置 | |
| B. | 电解池的形成条件中要求必须有电源,原电池的形成条件中不要求有电源 | |
| C. | 原电池的负极和电解池的阴极发生的反应类型一样,都是氧化反应 | |
| D. | 原电池的正极和电解池的阴极都是电子流入的一极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 人体呼出的气体中含有CO2,绿色植物的光合作用吸收CO2,CO2是一种有机化合物 | |
| B. | 水是生命之源,H2O是一种有机化合物 | |
| C. | 绝大多数的含碳物质是有机化合物 | |
| D. | 有机化合物可以转化为无机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
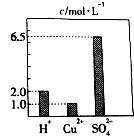 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
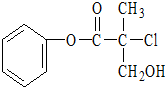 某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )| A. | 属于卤代烃,易溶于水 | |
| B. | 在酸性或碱性条件下都能发生水解反应 | |
| C. | 1molA可以与2molNaOH反应 | |
| D. | 一定条件下可发生加成反应和消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com